Новая концепция физиологии работы сердца
Ю.Л. Шевченко
Диплом на открытие № 531 от 10 февраля 2023 г.
Аннотация
Несмотря на современные знания физиологии здорового сердца, остается необъяснимой возможность этого органа выполнять колоссальную работу на протяжении всей жизни, энергии которой бы хватило для полета до Луны и обратно. Многолетние клинические наблюдения, экспериментальные исследования, морфологический анализ, а также изучение эмбриональных кардиомиоцитов, позволили предположить, что сердце функционирует по принципу поочередного сокращения кардиомиоцитов или их пучков («вахтовый принцип») — это дает возможность отдыха для восстановления структуры и энергии клеток сердца.
Заключение. Изучение и анализ таких физиологических явлений как фибрилляция, гибернация, поведение кардиомиоцитов в их эмбриональной культуре — косвенно подтверждают изложенную концепцию. Необходимо дальнейшее проведение экспериментальных и клинических исследований.
Ключевые слова: нормальная физиология, кардиомиоциты, поочередный принцип работы.
The phenomenon of alternating contraction of cardiomyocytes and their associations.
The new concept of the heart physiology.
Yu.L. Shevchenko
Annotation
Despite modern knowledge of the physiology of a healthy heart, it remains inexplicable that this organ can perform colossal work throughout life, the energy of which would be enough to fly to the moon and back. Long-term clinical observations, experimental studies, morphological analysis, as well as the study of embryonic cardiomyocytes, suggested that the heart functions according to the principle of alternating contraction of cardiomyocytes or their bundles (“shift principle”) — this makes it possible to rest and restore the energy of heart cells.
Conclusion. The study and analysis of such physiological phenomena as fibrillation, hibernation and the behavior of cardiomyocytes in their embryonic culture indirectly confirm the above concept. Further experimental and clinical studies are necessary.
Keywords: normal physiology, cardiomyocytes, alternating principle of contraction.
История изучения сердца как органа (эмбриология, анатомия, физиология) насчитывает несколько столетий. Но особенно в XX веке в физиологии кровообращения и сердца, в частности, были сделаны многие важные открытия. Накоплено большое количество знаний о функционировании системы, а также разработаны многие практические и клинические методы управления его деятельностью, а также сосудов и кровообращения в целом. Однако до сих пор этот «мотор жизни», с древности наделяемый различными функциями вплоть до сосредоточения души, представляется нам великой тайной. Слово « » во времена древних греков означало не только центральный орган кровообращения в прямом значении, но и душу, вместилище чувств и страстей, середину, желание, намерение, благоразумие и прочее [5].
» во времена древних греков означало не только центральный орган кровообращения в прямом значении, но и душу, вместилище чувств и страстей, середину, желание, намерение, благоразумие и прочее [5].
Часто можно слышать и читать: сердце «тоскует», «трепещет от радости», «предчувствует», «чувствует», «страдает», «скорбит», «рвется от гнева», «негодует», «замирает от страха, тревоги, отчаяния» и прочее [7]. Оно определяется еще и как тонкий и универсальный орган чувств, который обладает высшей способностью ощущать и любить Бога: «Возлюби Господа Бога твоего всем сердцем твоим» (Мф. 22:37), является источником жизни: «Больше всего хранимого храни сердце твое, потому что из него источники жизни» (Притч. 4:23).
Несмотря на то, что сегодня наука освободилась от оков предрассудков и стремится объяснить основные принципы физиологии сердца, остается еще много непонятного в принципах его функционирования. Особенной тайной представляется возможность этого органа к такой колоссальной физической работе на протяжении всей жизни. Этому вопросу и посвящены наши многочисленные наблюдения и размышления.
Эмбриология сердца
На третьей неделе развития плода под глоткой из скопления ангиогенных клеток (из мезенхимы) образуются парные эндокардиальные пузырьки, которые вытягиваются в трубки. Участки висцеральных листков мезодермы, прилежащие к ним, утолщаются и разрастаются, окружая зачаток эндокарда мешком, образуя миоэпикардиальную пластинку. Здесь содержатся элементы, образующие в дальнейшем миокард — мигрированные презумптивные клетки — кардиомиобласты. Перикард формируется из париетального листка висцеральной плевры [3] (рисунок 1).
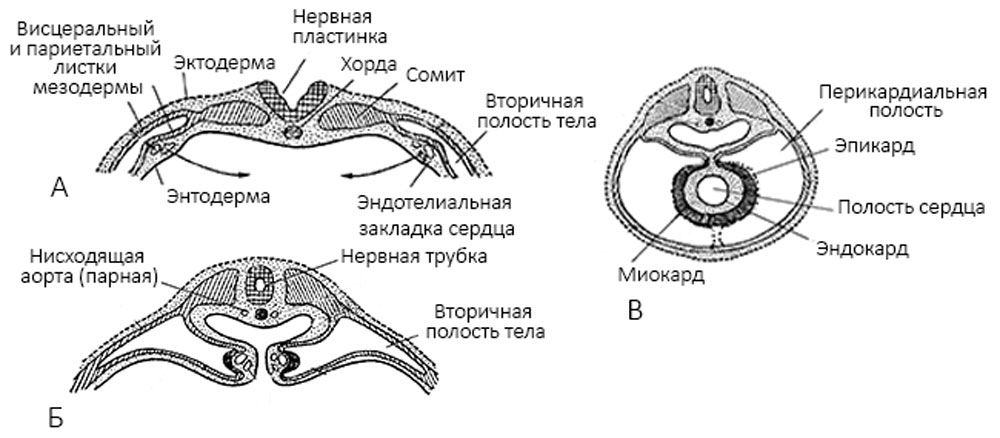
Рисунок 1. А-В — поперечные разрезы зародышей; А — две парные закладки сердца; Б — их сближение; В — их слияние в одну непарную закладку
Две трубки сливаются в одно трубчатое сердце, в котором выделяют артериальный конус, желудочек и венозный синус (рисунок 2).
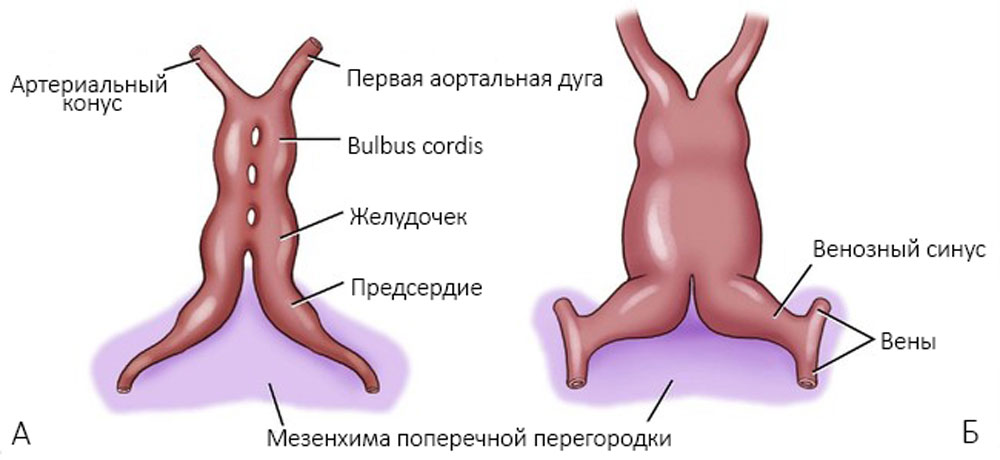
Рисунок 2. Формирование единой сердечной трубки. А — через 21 день, начало слияния; Б — на
Миоэпикардиальная пластинка прилежит к эндокарду сначала в области венозного синуса, затем предсердий и желудочков; отделяется от него только в местах, где впоследствии происходит образование клапанов — там сохраняется желеобразная субстанция [1]. Сердечная трубка растет в длину, изгибается (стадия S-образного сердца): венозный синус загибается назад и вверх, формируются ушки, желудочек смещается вперед и влево, артериальный конус опускается вперед и вниз [25] (рисунок 3).
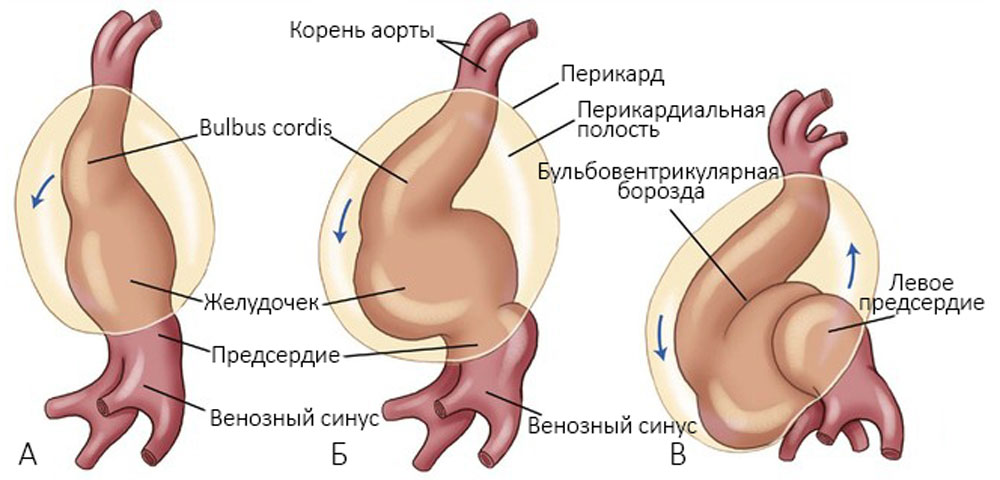
Рисунок 3. Формирование атриовентрикулобульбарной петли через 22 дня (А), через 23 дня (Б) и через 24 дня (В). По мере формирования этой петли образуется общее предсердие, которое входит в полость перикарда
В раннем трубчатом сердце эндокард представлен одним слоем рыхло расположенных эндотелиальных клеток. Миокард же состоит из рыхло расположенных полигональных или веретеновидных миобластов, образующих слой толщиной в
На пятой неделе благодаря разрастанию эндокардиальных валиков, друг другу навстречу формируются межпредсердная и межжелудочковая перегородки, разделяется артериальный ствол на аорту и легочный ствол с формированием клапанов [25] (рисунки 4-6).
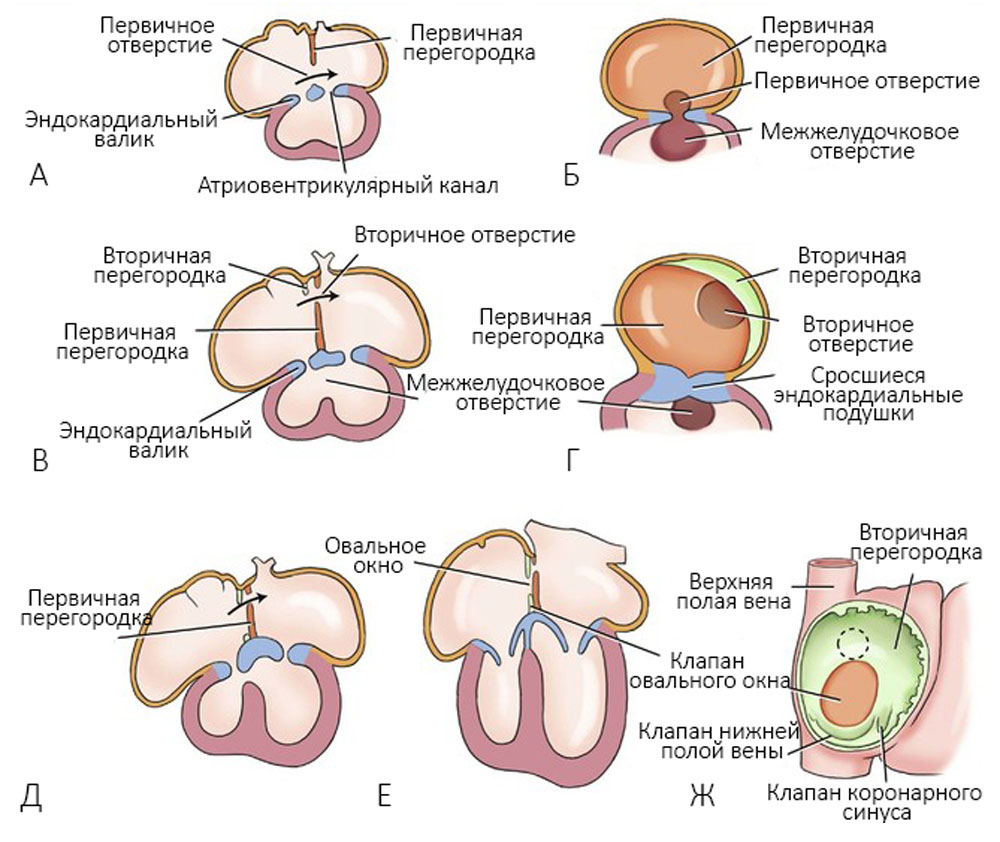
Рисунок 4. А — развитие межпредсердных перегородок через 30 дней; Б — та же стадия, вид справа; В — через 33 дня; Г — та же стадия, вид справа; Д — через 37 дней; Е — сердце новорожденного; Ж — вид межпредсердной перегородки справа
Кардиомиобласты продолжают процесс деления и на втором месяце эмбрионального развития в них появляются миофибриллы с поперечной исчерченностью. Z-полоски появляются одновременно с саркотубулярной сетью и поперечными инвагинациями клеточной мембраны (Т-системы). На плазмолеммах контактирующих миобластов образуются десмосомы. Формирующиеся миофибриллы прикрепляются к плазмолеммам, где позднее образуются вставочные диски. Начинает формироваться проводящая система сердца. Развитие мышечной ткани левого желудочка происходит быстрее, чем правого. Параллельно происходит увеличение правого и левого гребней в артериальном стволе, формируется мембранозная часть межжелудочковой перегородки [6, 13] (рисунок 5).
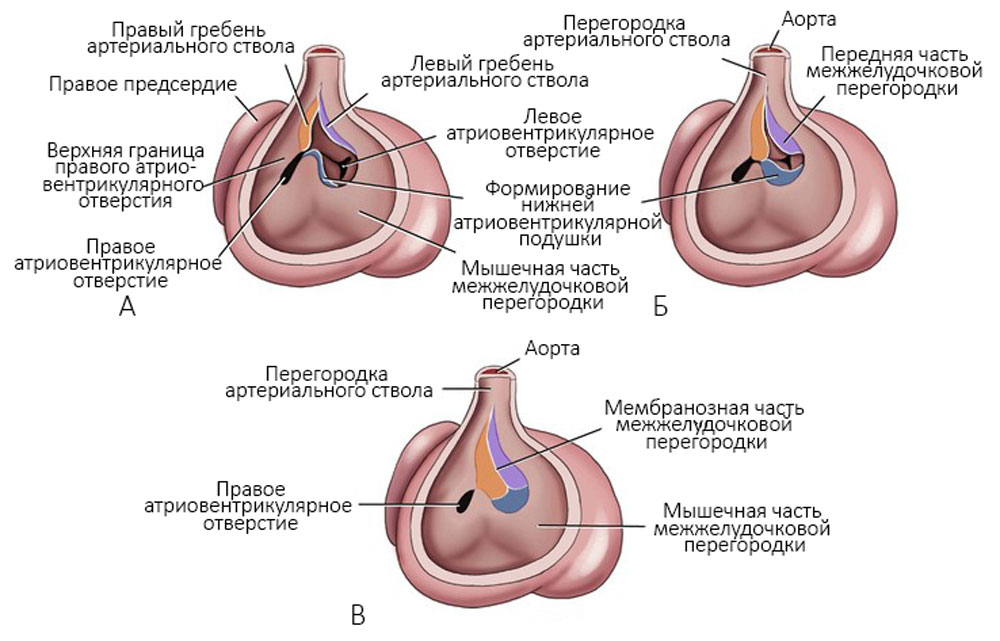
Рисунок 5. Развитие гребней артериального ствола и закрытие межжелудочковой перегородки. А — через 6 недель; Б — начало седьмой недели; В — конец седьмой недели
Аорта и легочная артерия закручиваются друг вокруг друга, и создается аортально-легочная перегородка (рисунок 6).
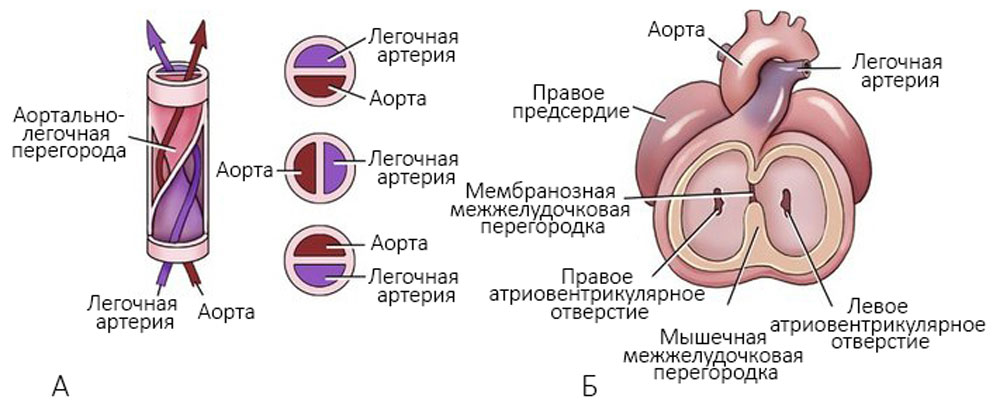
Рисунок 6. А — формирование аортально-легочной перегородки; Б — разделение аорты и легочной артерии на восьмой неделе развития
Увеличение массы миокарда в эмбриональном периоде происходит как за счет митозов, так и за счет увеличения размеров клеток. Постэмбриональное сердце растет (даже в случаях гипертрофии) без увеличения количества кардиомиоцитов. Увеличение диаметра волокон миокарда связано с увеличением массы цитоплазмы, главным образом за счет новообразования миофибрилл внутри каждой клетки [4].
Формирование сократительной системы кардиомиоцита
Миофибриллогенез в кардиомиоцитах начинается с образования премиофибрилл, мелких околомембранных филаментарных структур, которые состоят в основном из гладкомышечного альфа-актина и немышечного миозина II типа B [24]. Альфа-актинин вместе с актином он формирует Z-тельца, предшественники Z-дисков (границы и опорные структуры саркомера).
Созревающие фибриллы образуются путем слияния премиофибрилл на уровне Z-телец, далее в эти структуры включаются саркомерный миозин, актин и титин, определяющей размеры саркомера и правильное расположение филаментов. В этот же период гладкомышечный актин и немышечный миозин IIB покидают сократительный домен саркомера. В результате созревания происходит дальнейшее латеральное укрупнение миофибрилл с образованием зрелых саркомеров (рисунок 7) [45].
Сокращение саркомеров происходит путем ATФ-зависимого втягивания актиновых филаментов внутрь саркомера благодаря моторной активности миозиновых филаментов [17].
Стабильность премиофибрилл является критическим фактором саркомерогенеза в эмбриональных кардиомиоцитах. Условие стабилизации немышечного миозина IIB — его фосфорилирование в основном киназой легких цепей миозина (КЛЦМ) или взаимодействие с белком, связанным с киназой, — KRP (Kinase-Related Protein). Инактивация КЛЦМ или KRP приводит к ингибированию саркомерогенеза [18, 21, 26].
![Рисунок 7. Этапы миофибриллогенеза в кардиомиоцитах: 1 — закладка премиофибрилл вблизи мембраны кардиомиоцита и их перемещение вглубь саркоплазмы; 2 — слияние премиофибрилл и встраивание в них саркомерных белков, формирование созревающих миофибрилл; 3 — образование зрелых миофибрилл саркомерного типа путем структуризации и укрупнения созревающих миофибрилл. Справа: иммунофлуоресцентное окрашивание кардиомиоцита куриного эмбриона. КЛЦМ выявляется в Z-дисках зрелых саркомеров и локализуется вместе с немышечным миозином IIB в миофибриллярных предшественниках (стрелка) [17]](/etc/2022/princip-poocherednogo-sokraschenia-kardiomiocitov-7.jpg)
Рисунок 7. Этапы миофибриллогенеза в кардиомиоцитах: 1 — закладка премиофибрилл вблизи мембраны кардиомиоцита и их перемещение вглубь саркоплазмы; 2 — слияние премиофибрилл и встраивание в них саркомерных белков, формирование созревающих миофибрилл; 3 — образование зрелых миофибрилл саркомерного типа путем структуризации и укрупнения созревающих миофибрилл. Справа: иммунофлуоресцентное окрашивание кардиомиоцита куриного эмбриона. КЛЦМ выявляется в Z-дисках зрелых саркомеров и локализуется вместе с немышечным миозином IIB в миофибриллярных предшественниках (стрелка) [17]
Морфологическая структура миокарда
Миокард по структуре и функции неоднороден. В нем можно выделить два основных типа волокон: типичные кардиомиоциты и специализированные (атипичные). Типичные образуют основную массу сердечной мышцы стенок предсердий и желудочков — это сократительный миокард. Кроме того, часть кардиомиоцитов предсердий (особенно правого) обладает способностью к секреции — представляют собой секреторные кардиомиоциты. Ими вырабатывается натрийуретический пептид, увеличивающий выведение ионов натрия почками и вызывающий снижение артериального давления. Атипичные волокна образуют проводящую систему сердца [11, 36].
В клетках кардиомиоцитов много митохондрий, что указывает на интенсивный аэробный обмен веществ. В них также много миофибрилл, которые расположены строго упорядоченно, что придает типичному миокарду поперечную исчерченность. Сарколемма мышечных волокон образует Т-систему для проведения возбуждения вглубь волокна. Саркоплазматический ретикулум, который является местом накопления ионов кальция, в миокарде развит неотчетливо; в отличие от скелетной мышцы, Т-трубочки проходят на уровне Z-линий и контактируют чаще с одной терминальной цистерной, формируя диады.
Границами клеток являются вставочные диски, образованные плазматическими мембранами двух соседних кардиомиоцитов. Одним из элементов вставочных дисков являются десмосомы — служат для фиксации клеток и миофибрилл, так как включают склеивающее вещество. Другим элементом вставочных дисков является нексус — участок тесного контакта с низким электрическим сопротивлением, включающий ионные каналы (рисунок 8) [30].
![Рисунок 8. Структура кардиомиоцита. Указано расположение ключевых органелл и мембранных компонентов [42]](/etc/2022/princip-poocherednogo-sokraschenia-kardiomiocitov-8.jpg)
Рисунок 8. Структура кардиомиоцита. Указано расположение ключевых органелл и мембранных компонентов [42]
Отдельные волокна кардиомиоцитов окружены эндомизием, группа волокон — перимизием. Это рыхлая соединительная ткань, представленная коллагеновыми волокнами, различными клетками (эндотелиальными, иммунными, клеток стенок сосудов) и межклеточным веществом. Эндомизий и перимизий обеспечивают не только структурную, но и функциональную целостность миокарда, происходит передача сократительного импульса, регулируется взаимодействие между кардиомиоцитами, а также межфибриллярное пространство является дополнительным депо различных элементов, в том числе внеклеточных ионов кальция [28] (рисунок 9).

Рисунок 9. Пучки кардиомиоцитов в норме, окружены перимизием; визуализируются вставочные диски, анастомозы (гистологический препарат, окраска по Ван-Гизону, увеличение х400)
Регуляция сердечной деятельности
Приспособление сердечной деятельности к изменяющимся потребностям организма осуществляется с помощью механизмов миогенной, нервной и гуморальной регуляции.
Механизмами миогенной регуляции являются гетерометрический и гомеометрический.
Гетерометрический механизм заключается в увеличении силы сердечных сокращений по мере растяжения миокарда — закон Франка Старлинга: «чем больше мышца сердца растягивается в диастолу, тем сильнее ее сокращение в период систолы». Однако при ее перерастяжении, сила сокращений и систолический объем крови падают. Гетерометрический механизм наиболее чувствителен и включается раньше других [35] (рисунок 10).
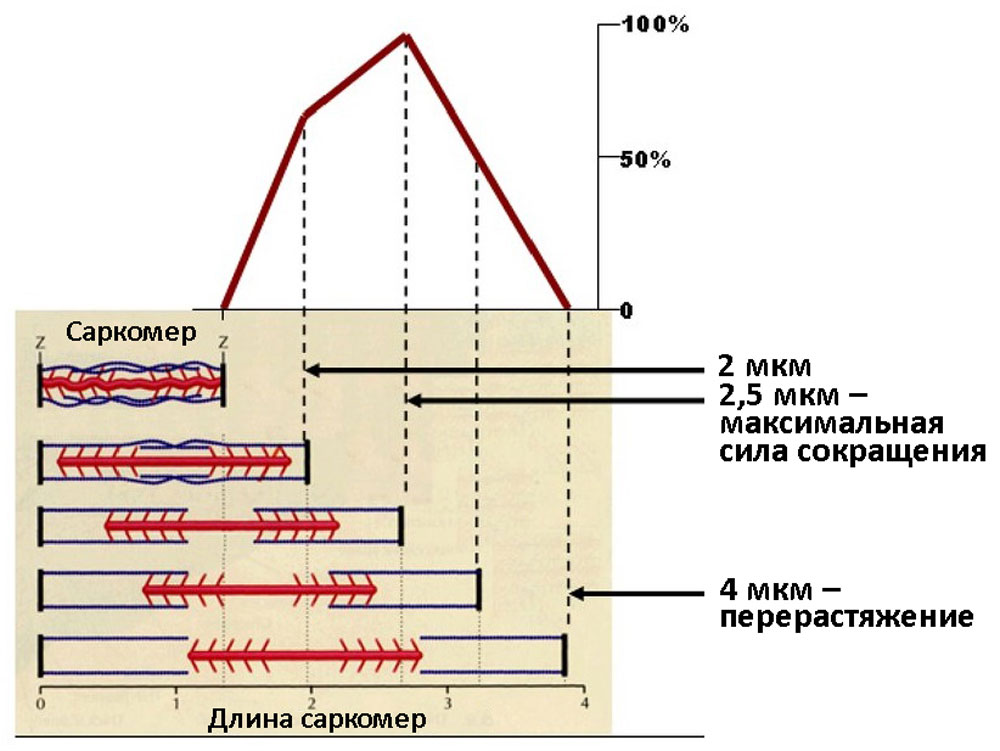
Рисунок 10. Графическое изображение закона Франка Старлинга
Гомеометрические механизмы не связаны с растяжением миокарда. Наиболее важным из них является эффект Анрепа — при увеличении давления в аорте систолический объем первоначально снижается. Затем сила сокращений и систолический выброс растут [22] (рисунок 11).
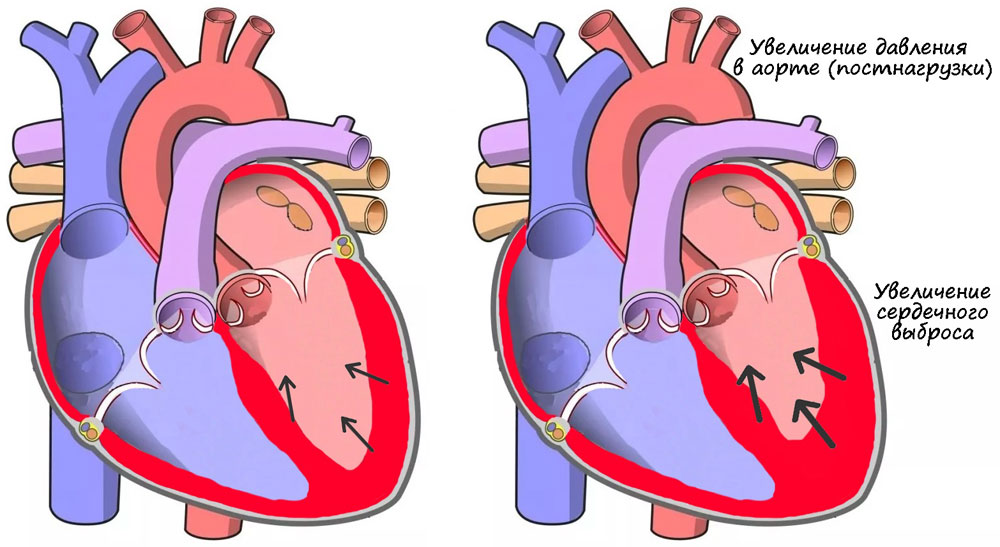
Рисунок 11. Эффект Анрепа: увеличение постнагрузки приводит к усилению сердечного выброса
Миогенные механизмы регуляции обеспечивают приспособление кровообращения к относительно кратковременным нагрузкам. При длительном повышении нагрузки возникает рабочая гипертрофия миокарда: увеличиваются длина и диаметр мышечных волокон. При постоянной перегрузке одного отдела сердца также возникает его гипертрофия [46].
Нервная регуляция деятельности сердца в связи с изменяющимися потребностями организма осуществляются интракардиальными, и экстракардиальными механизмами. Сердце все оплетено сетью волокон симпатической нервной системы, а также иннервируется блуждающим нервом. Иннервация сердца поразительно богата и сложна.
Однако даже денервированное, пересаженное в другой организм сердце продолжает сокращаться благодаря свойству автоматизма, которое обеспечивается спонтанной генерацией потенциала действия пейсмекерными клетками синоатриального узла. В этих клетках во время диастолы цитоплазматическая мембрана медленно спонтанно деполяризуется, благодаря этому на ней самопроизвольно генерируется потенциал действия [12, 14, 27] (рисунок 12).
К внутрисердечным регуляторным механизмам относятся внутриклеточные механизмы регуляции, регуляция межклеточных взаимодействий и внутрисердечные периферические рефлекторные механизмы. В сердце имеется развитая внутрисердечная нервная система, включающая афферентные, эфферентные, вставочные нейроны и нервные сплетения. Ее считают отделом метасимпатической нервной системы [8]. Она начинает участвовать в регуляции сердечной деятельности лишь после потери экстрамуральной иннервации.
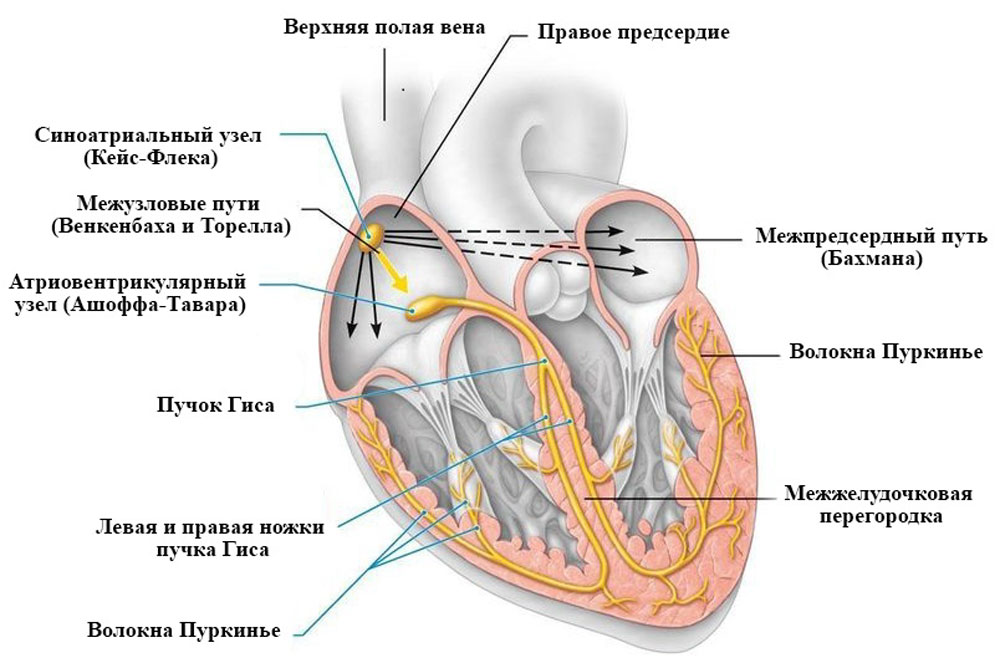
Рисунок 12. Проводящая система сердца
К экстракардиальным механизмам относят холинергические, адренергические, серотонинергические, пуринергические и нитрергические нервные факторы регуляции сердечной деятельности.
Ядра блуждающего нерва расположены в продолговатом мозге, окончания его заканчиваются на интрамуральных ганглиях. Постганглионарные волокна правого n.vagus идут к cиноатриальному узлу, а левого — к атриовентрикулярному (рисунки 13, 14). Благодаря такой иннервации, правый n.vagus влияет преимущественно на ЧСС, а левый на скорость проведения возбуждения в АВ узле. Кроме того, они иннервируют миокард соответствующих предсердий, а желудочки иннервируются в меньшей степени. Блуждающий нерв обеспечивает иннервацию кровеносных и лимфатических сосудов [32].
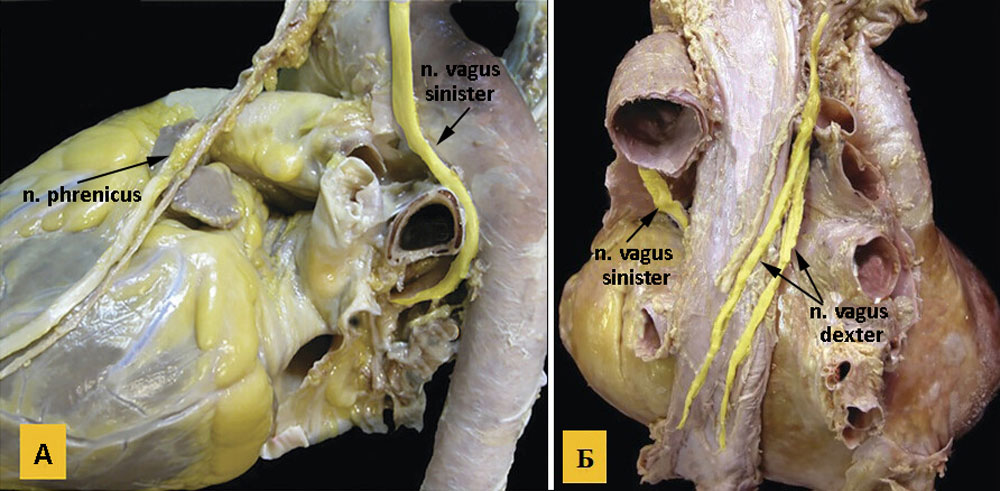
Рисунок 13. А — ход левого диафрагмального нерва, который спускается на перикард спереди и латеральнее дуги аорты, и левого блуждающего нерва; Б — вид сзади после удаления нисходящей грудной аорты, ход правого и левого блуждающих нервов
Ацетилхолин, выделяемый окончаниями блуждающих нервов, связывается с М-холинорецепторами кардиомиоцитов и вызывает гиперполяризацию их мембраны, обеспечивая тем самым отрицательные хронотропный, инотропный, дромотропный и батмотропный эффекты [33].
Тела симпатических нейронов, иннервирующих сердце, расположены в боковых рогах
Медиатор симпатических нервов норадреналин взаимодействует с b1-адренорецепторами мембраны кардиомиоцитов. Происходит ее деполяризация, а в результате ускоряется медленная диастолическая деполяризация в Р-клетках синоатриального узла, увеличиваются амплитуда и длительность генерируемых потенциалов действия, возрастает возбудимость клеток проводящей системы. Вследствие этого повышаются возбудимость, автоматия, проводимость и сила сокращений сердечной мышцы. Тонус симпатических центров регуляции сердечной деятельности выражен значительно слабее, чем парасимпатических [23].
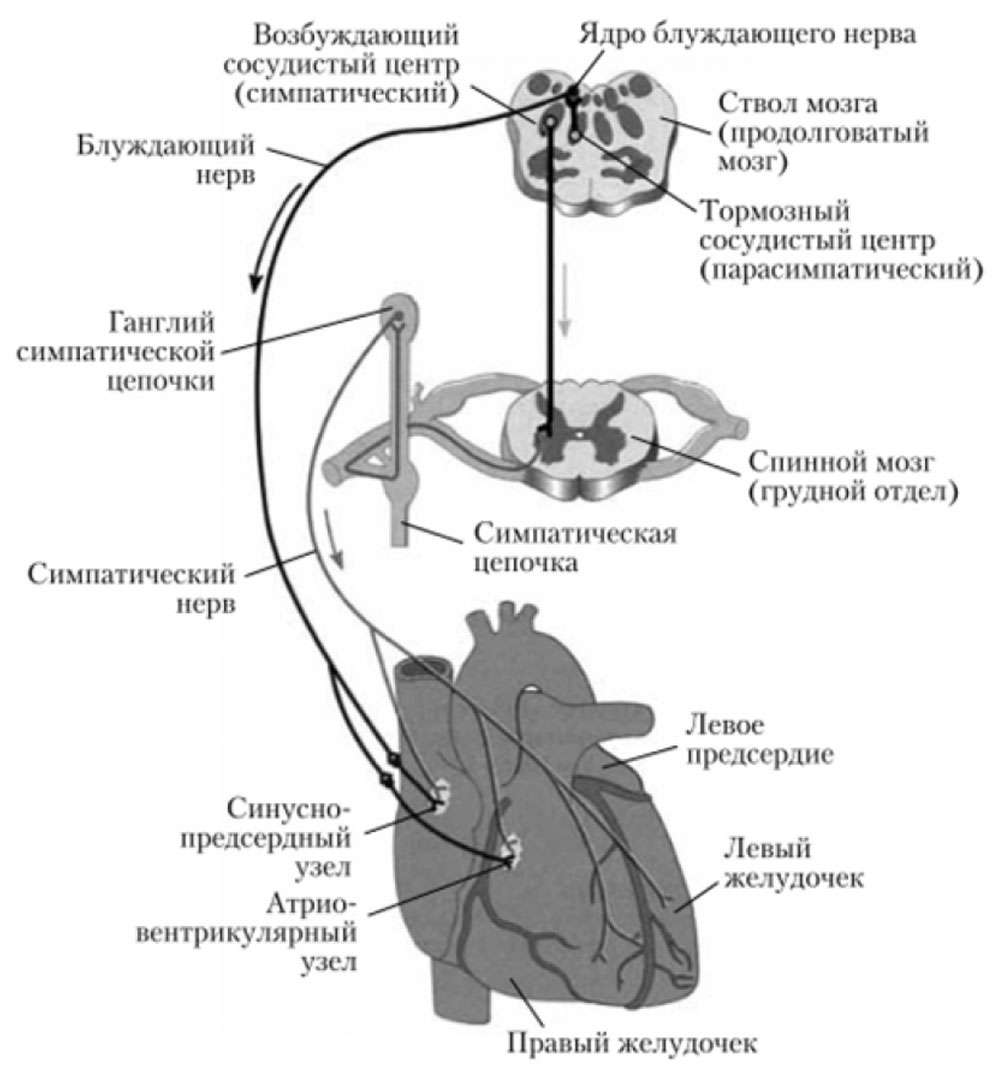
Рисунок 14. Иннервация сердца
Рефлекторная и гуморальная регуляция деятельности сердца
Сердечные рефлексы:
- Кардио-кардиальные — возникают при раздражении механорецепторов самого сердца. Например, рефлекс Бейнбриджа: учащение сердцебиения при растяжении правого предсердия [40].
- Кардио-вазальные — при возбуждении баро- и хеморецепторов сосудов: с рефлексогенных зон дуги аорты, разветвлений или синусов сонных артерий, других крупных артерий [34].
- Сопряженные — связаны с возбуждением рецепторов, не относящихся к системе кровообращения, например, рефлексы Гольца (снижение ЧСС при механическом раздражении брюшины или органов брюшной полости) и Данини-Ашнера (урежение частоты сокращений при надавливании на глазные яблоки) [44].
В регуляции работы сердца участвуют и факторы гуморальной системы. Адреналин и норадреналин надпочечников действуют подобно симпатическим нервам. Тироксин повышает чувствительность кардиомиоцитов к действию катехоламинов, а также стимулирует метаболизм клеток: вызывает учащение и усиление сердцебиений. Глюкокортикоиды улучшают обмен веществ в сердечной мышцы и способствуют повышению ее сократимости.
Работа сердца весьма зависима от ионного состава крови. При увеличении содержания кальция в крови частота и сила сердечных сокращений возрастают. При снижении — уменьшаются. Это связано с большим вкладом ионов кальция в генерацию потенциала действия и сокращения кардиомиоцитов. Повышение концентрации ионов калия приводит к уменьшению частоты и силы сердечных сокращений [10].
Физиология сократительной функции сердца
За прошедшие три столетия механическая работа сердца оставалась одним из наиболее интригующих аспектов для физиологов и клиницистов, изучающих этот орган. Еще в 1669 г. Lower R. было описано уникальное движение скручивания левого желудочка. Наибольший вклад в изучение строения сердца, позволивший объяснить многие физиологические аспекты его сокращения, внес испанский ученый Francisco Torrent Guasp
Спираль в виде двух витков разделяет полости правого и левого желудочков. Базальный цикл миокарда желудочков располагается перпендикулярно к длинной оси желудочков, его волокна огибают правую, левую стороны и полностью верхушку. А нисходящие и восходящие сегменты апикального цикла имеют преимущественно вертикальное направление (рисунки 15, 16).
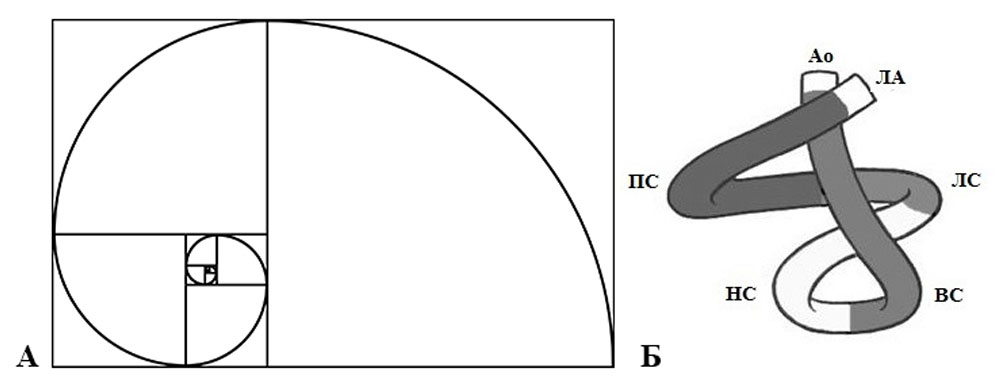
Рисунок 15. Математическое обоснование золотого сечения Пифагора и логарифмической спирали Фибоначчи (А) применимо к описанию спирали миокарда желудочков (Б). Длина сегментов полосы составляет гармоничную пропорцию золотого сечения (ПС — правый, ЛС — левый, НС — нисходящий и ВС — восходящий сегменты)
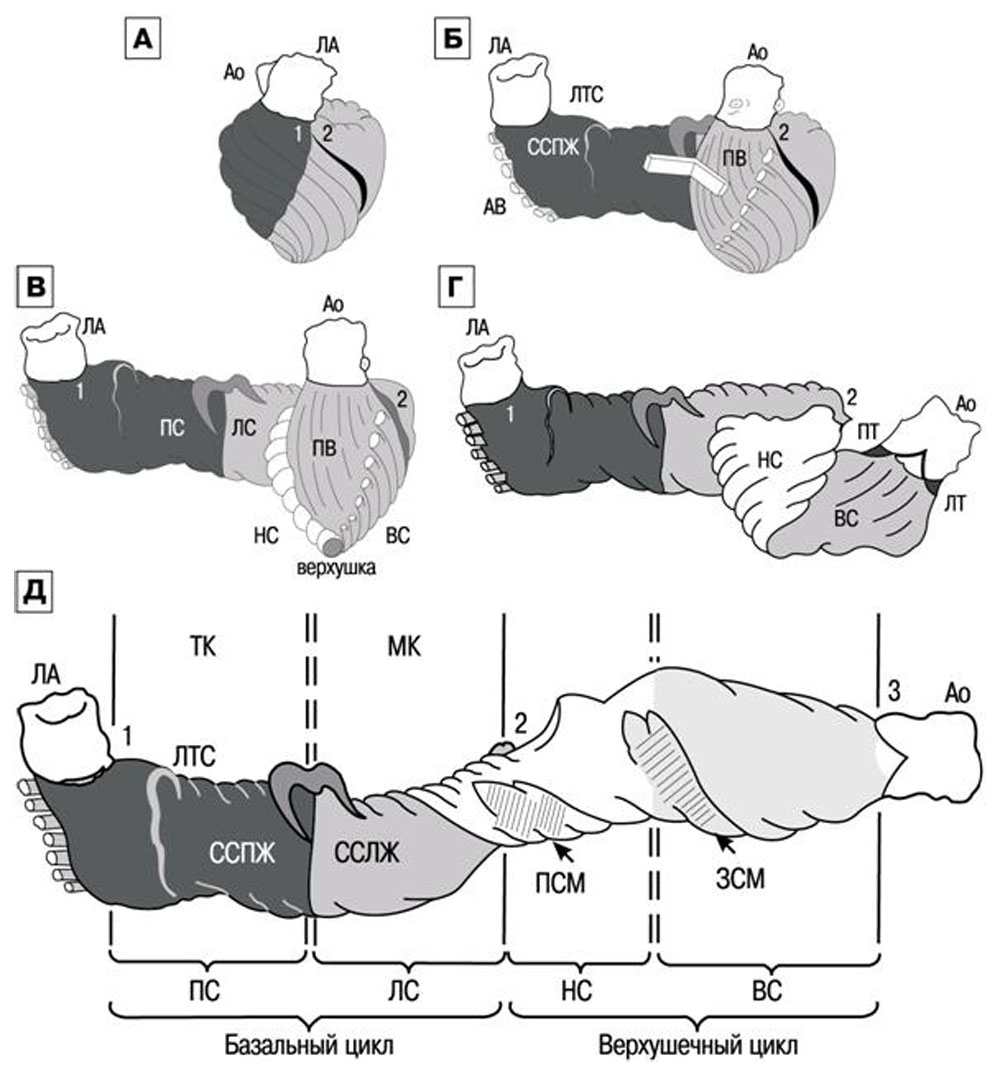
Рисунок 16. Схема по F. Torrent-Guasp. А — исходный вид; Б —базальный цикл, (В) состоящий из правого (ПС) и левого (ЛС) сегментов; Г — верхушечный цикл из нисходящего (НС) и восходящего (ВС) сегментов. Д — развернутая полоса миокарда желудочков: 1 — корень легочной артерии (ЛА) 2 — центральный сгиб полосы; 3 — корень аорты (Ао). ССПЖ — свободная стенка правого, ССЛЖ — левого желудочка; ЛТС — легочно-трикуспидальное фиброзное соединение, МК — уровень створок митрального клапана, ПСМ — передняя, ЗСМ — задняя сосочковые мышцы, ПТ — правый, ЛТ — левый треугольник аорты. Двойная пунктирная линия — уровень задней межжелудочковой борозды в развернутом виде
Спиральная конфигурация «полосы» включает четыре участка или сегмента, волокнам каждого из них присуще свое направление движения. Сокращение заключается в поочередном движении сегментов. Миокард базального цикла сокращается таким образом, что сначала возбуждается свободная стенка правого желудочка, затем — левого желудочка. Приводит к плотному круговому охвату желудочков до верхушки и увеличению внутриполостного давления (в это время желудочки заполнены несжимаемой кровью, и атриовентрикулярные клапаны закрыты).
Из апикального цикла первым сокращается нисходящий сегмент, происходит укорочение длинной оси желудочков, спиральное вращение, изменение размера и формы АВ отверстий. Движение подобно «выкручиванию мокрого полотенца». В результате длинная ось ЛЖ укорачивается, уменьшается объем ЛЖ и это приводит к изгнанию крови в аорту.
Движение восходящего сегмента является ключом к пониманию «тайны» наполнения желудочков. Оба сегмента верхушечного цикла вращаются вокруг динамической «точки опоры», которая представлена определенным объемом крови, находящимся в полости желудочков сердца («hemoskeleton», каркас крови). Чем больше гемоскелетон, тем меньше рычаг. Преобладающее косое направление волокон восходящего сегмента дополнительно усиливается предыдущим сокращением нисходящего, к тому же используется в качестве точки опоры меньший гемоскелетон (остаточный объем), поэтому достигается максимальный эффект: происходит удлинение желудочка при сокращении миокарда, раскручивание основания, увеличение размера и изменение формы атриовентрикулярных отверстий. В результате, создается мощная сила всасывания предсердной крови [2].
Сокращение (систола) миокарда, продолжительностью 0,3 с, по времени, примерно, совпадает с длительностью общей рефрактерности, представляющей собой сумму абсолютной и относительной (рисунок 17). Следовательно, в периоде сокращения сердце не способно реагировать на другие раздражители [39].
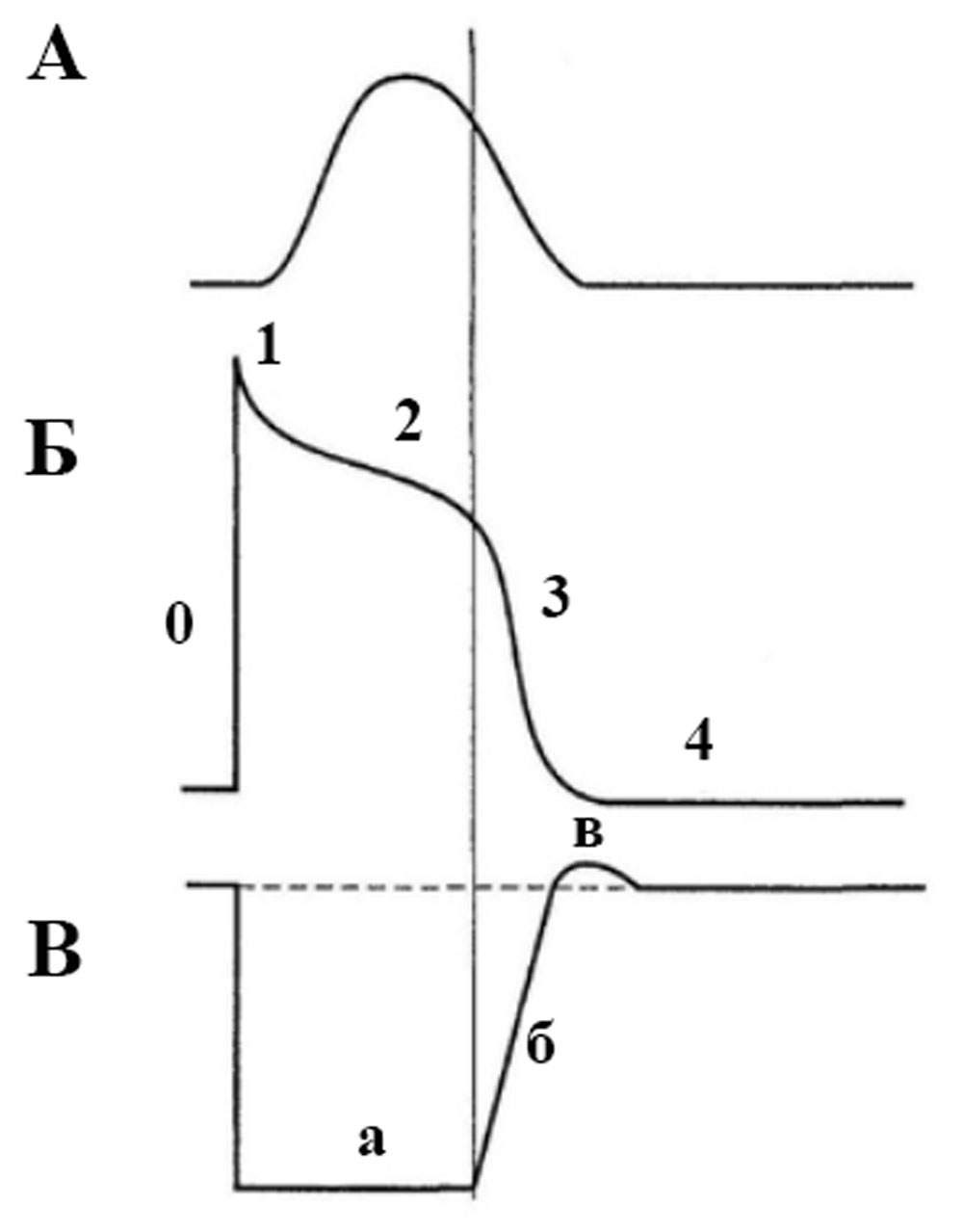
Рисунок 17. Сопоставление потенциала действия и сокращения миокарда с фазами изменения возбудимости: А — кардиограмма. Б — потенциал действия кардиомиоцита, фаза 0 — деполяризация (происходит быстрый вход ионов натрия внутрь клетки), фаза 1 — ранняя быстрая реполяризация (транзиторный выход калия из клетки), фаза 2 — плато (проникновение через медленные каналы кальция в клетку препятствует реполяризации), фаза 3 — быстрая конечная реполяризация (выход ионов калия из клетки, замедление входа натрия и кальция), фаза 4 — покоя (равновесие деполяризующих и реполяризующих токов). В — динамика возбудимости (пунктирной линией обозначена исходная возбудимость; а — абсолютная рефрактерность, б — относительная рефрактерность, в — супернормальная возбудимость). Рефрактерность миокарда практически совпадает не только с возбуждением, но и с периодом сокращения
Интересно представить работу сердца здорового человека при беге, когда ЧСС может достигать
Новый взгляд на физиологию сердечной деятельности
Выдающиеся умы человечества на протяжении веков изучали работу сердца, но в основном внимание было посвящено «больному» сердцу. Разработаны различные медикаментозные, физические и хирургические методы лечения сердечно-сосудистых заболеваний. При этом сложилась парадоксальная ситуация, что о «больном» сердце мы знаем гораздо больше, чем о «здоровом». Нам не всегда дано объективно оценить его резервы и возможности при тех огромных нагрузках, которые порой испытывает сердце.
Остается непонятным, как всего
Но все это становится особенно удивительным и необъяснимым, если учесть, что после завершения эмбрионального развития сердца, кардиомиоциты значимо не увеличиваются в количестве. Пожалуй, это главная тайна сердца!
Видео 1. Сравнение объема работы сердца, его энергетических возможностей
В результате многолетних, многочисленных клинических и экспериментальных наблюдений, размышлений и анализа встречающихся явлений в живой природе, касающихся физиологии кровообращения, была предложена новая концепция, объясняющая принцип функционирования сердца. В основе этой концепции — принцип поочередной (сменной, вахтовой) работы кардиомиоцитов или их пучков (ассоциаций). Это позволяет предположить, что увеличение времени диастолы (расслабления) клеток способствует более полноценному восстановлению их энергии.
В нашей жизни мы часто наблюдаем и используем принцип подобного режима работы различных механизмов: функционирование многоцилиндрового двигателя внутреннего сгорания обеспечивает большую мощность, уменьшается изнашиваемость (видео 2).
Видео 2. Функционирование многоцилиндрового двигателя внутреннего сгорания
Последовательное отсоединение двигателей при запуске многоступенчатой ракеты в космос позволяет эффективно достигнуть скорости большей, чем каждая из ступеней в отдельности (видео 3).
Видео 3. Последовательное отсоединение ступеней при запуске ракеты
Поочередная работа новогодних гирлянд уменьшает нагревание и увеличивает продолжительность функционирования световых элементов (видео 4).
Видео 4. Поочередная работа лампочек разного цвета новогодней гирлянды
По этому принципу организована караульная служба в военных формированиях и организация работы на всяких гражданских производствах. Сменившийся с поста два часа бодрствует в специальном помещении, а в следующей комнате два часа спит другой караульный перед заступлением на пост. И так в течение суточного дежурства происходит поочередная смена (рисунок 18). В случае тревоги весь состав караула выдвигается на пост, а после устранения чрезвычайной ситуации восстанавливается обычный режим посменной работы.
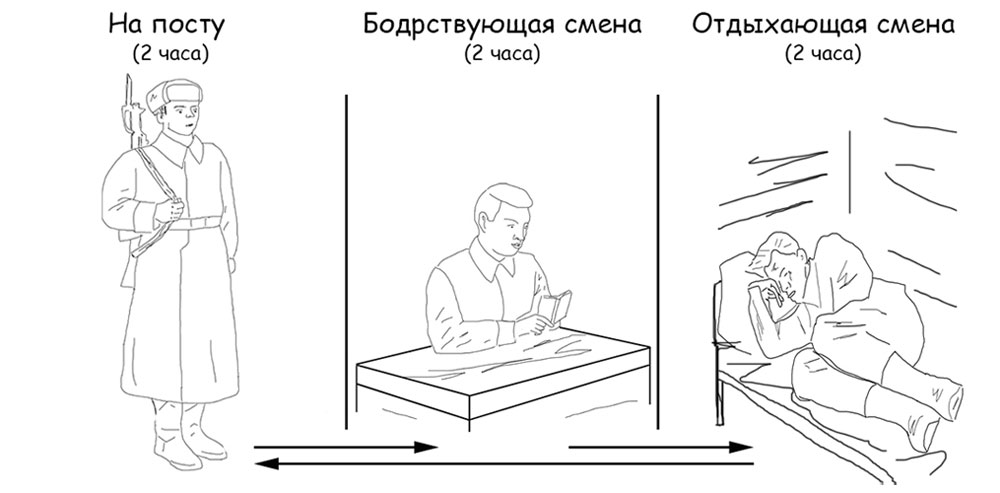
Рисунок 18. Пример организации караульной службы
Видео 5. Смена караула на посту
В природе, например, у дельфинов поочередно работают полушария головного мозга. Дыхательные паузы у черноморских афалин, как правило, длятся всего 15 секунд, они плывут непрерывно от рождения до смерти, что побудило исследовать работу их мозга. При регистрации электроэнцефалографии (ЭЭГ) была зафиксирована межполушарная асимметрия и выявлен однополушарный сон (рисунок 19).
![Рисунок 19. Развитие эпизода однополушарных медленных волн ЭЭГ в левом (Л) полушарии при десинхронизации в правом (П) полушарии дельфина-афалина. А, В, С — непрерывная регистрация, D — правосторонние дельта-волны ЭЭГ [38]](/etc/2022/princip-poocherednogo-sokraschenia-kardiomiocitov-19.jpg)
Рисунок 19. Развитие эпизода однополушарных медленных волн ЭЭГ в левом (Л) полушарии при десинхронизации в правом (П) полушарии дельфина-афалина. А, В, С — непрерывная регистрация, D — правосторонние дельта-волны ЭЭГ [38]
Во время операции на открытом сердце мы нередко видим сокращение разных зон при восстановлении сердечной деятельности после кардиоплегии, даже можем наблюдать поочередное сокращение правого и левого желудочков. Явление гибернации миокарда, впервые описанное еще в 1973 году Kanu Chatterjee, само по себе демонстрирует возможность отдыха определенных ассоциаций кардиомиоцитов и возобновления их работы после восстановления перфузии в этих сегментах. Этот факт доказан многочисленными клиническими наблюдениями при сцинтиграфическом контроле результатов хирургической коррекции нарушений коронарного кровотока [15, 16, 19, 20, 29, 31].
Также при фибрилляции сердца можем наблюдать явные сокращения разных участков и сегментов миокарда (рисунок 20, видео 6).
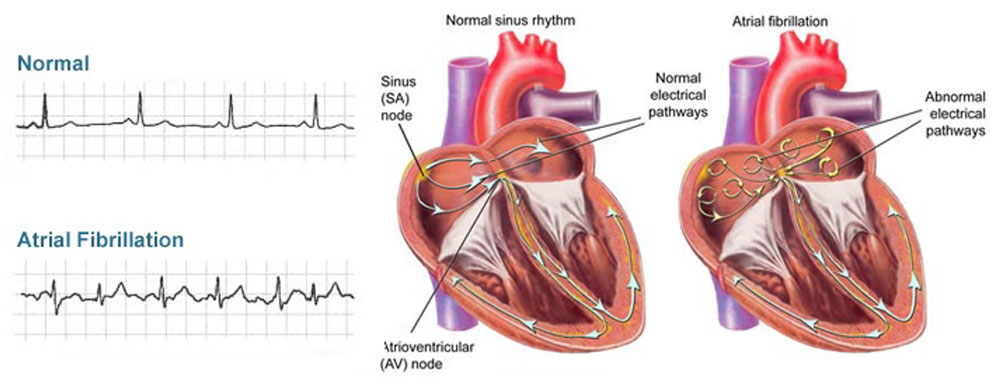
Рисунок 20. Сокращение сердца при нормальном ритме и при фибрилляции предсердий
Видео 6. Фибрилляция желудочков
При изучении в лабораторных условиях культуры эмбриональных кардиомиоцитов, можно явно наблюдать этот принцип их работы — поочередное сокращение клеток и их групп (рисунок 21) [43].

Рисунок 21.
Демонстрация сокращений ассоциаций эмбриональных кардиомиоцитов в разные сроки культивирования
Видео 7. Вторая неделя культивирования: начало сокращений ассоциаций эмбриональных кардиомиоцитов
Видео 8. Третья неделя культивирования: более активное сокращение ассоциаций эмбриональных кардиомиоцитов
Многочисленные наблюдения подобного рода фактов позволяют полагать, что «вахтовый метод» работы отдельных кардиомиоцитов или пучков клеток дает возможность в диастолу восстановить энергию до следующего эффективного сокращения.
Экспериментальная часть
Экспериментальные исследования проводили на кроликах породы шиншилла, все манипуляции с животными проведены согласно принципам гуманного отношения к животным в соответствии с Международными рекомендациями, а также с соблюдением биоэтических норм и требований Международного комитета по науке.
Электромиографически регистрировали импеданс миокарда с помощью нескольких пар электродов, введенных субэпикардиально, прежде всего, в переднюю стенку левого желудочка (рисунок 22).
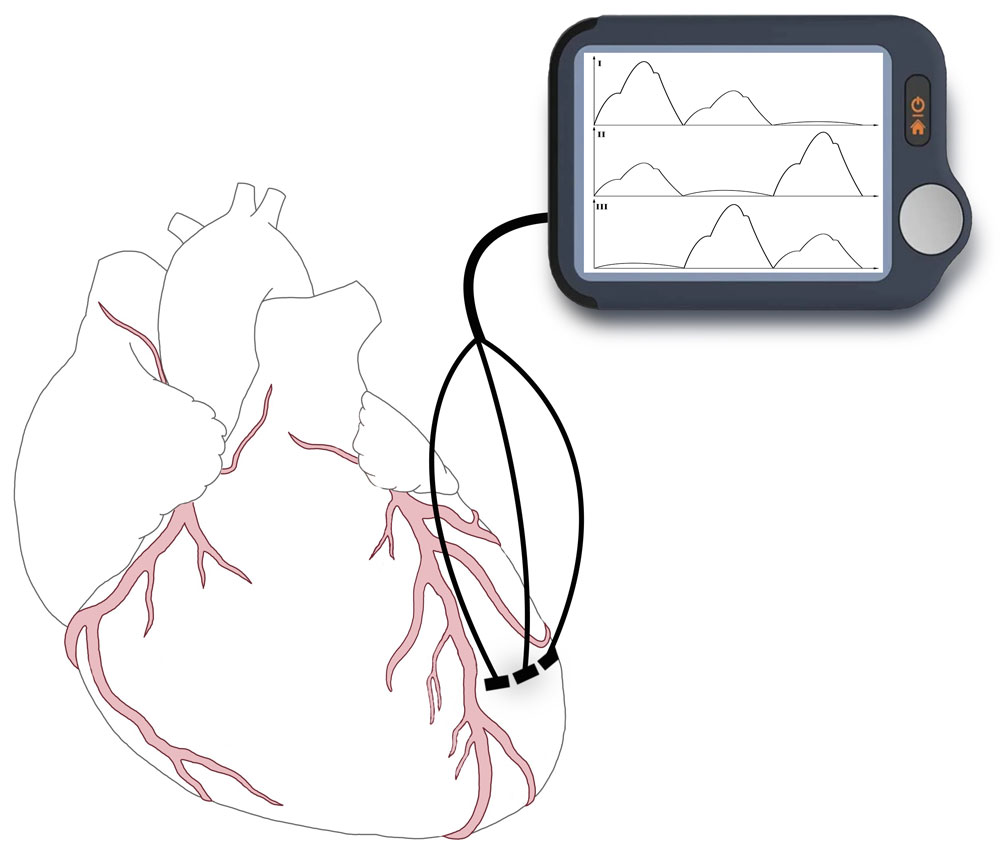
Рисунок 22. Схема подключения электродов к сердцу
Отмечалось колебание показателя сопротивления участков миокарда между регистрирующими электродами. Для оценки изменения сопротивления миокарда на кривой импедансограммы измеряли амплитуду волн, а также во время эксперимента определялась частота сердечных сокращений, величина систолического, диастолического и пульсового давления.
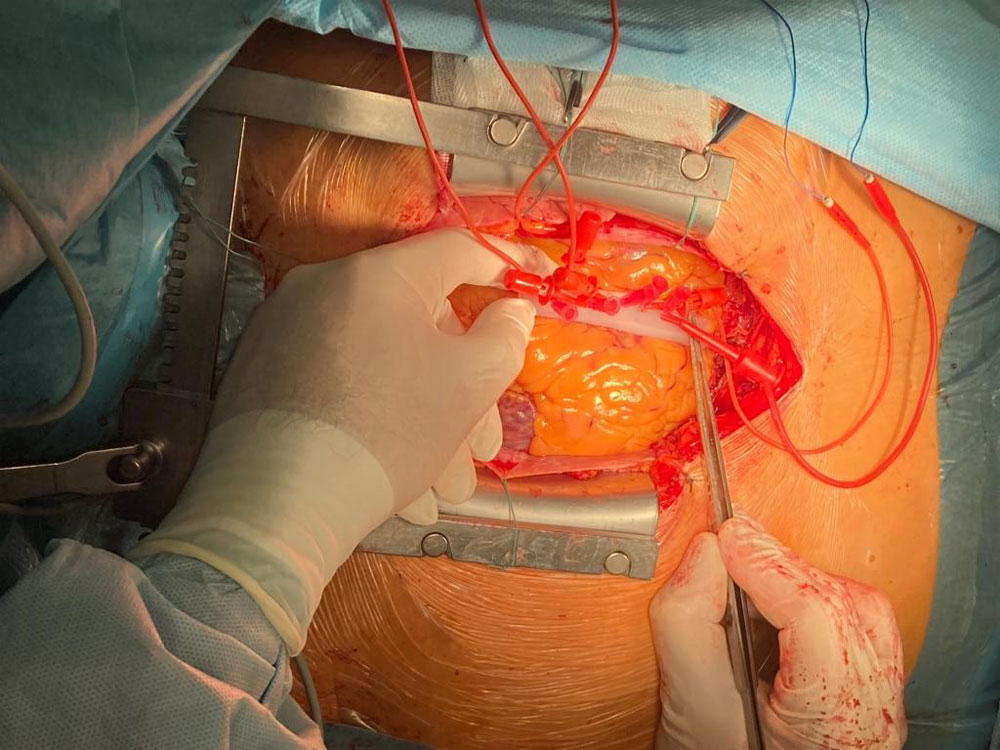
Рисунок 23. Выполнение интрамиокардиальной электрокардиографии
После серии проведенных экспериментов, оказалось, что одномоментно в миокарде существует три кластера кардиомиоцитов с различными чередующимися колебаниями сопротивления высокой, промежуточной и минимальной интенсивности, что косвенно демонстрирует посменную работу пучков мышечных клеток сердца (видео 9).
Видео 9. Посменная работа кардиомиоцитов (происходит сокращение отдельных кардиомиоцитов; увеличивается диастолический период у клеток)
По-видимому, возможны различные режимы работы кардиомиоцитов: смена через разное количество сокращений, или после группы сокращений (рисунок 24, видео 10).
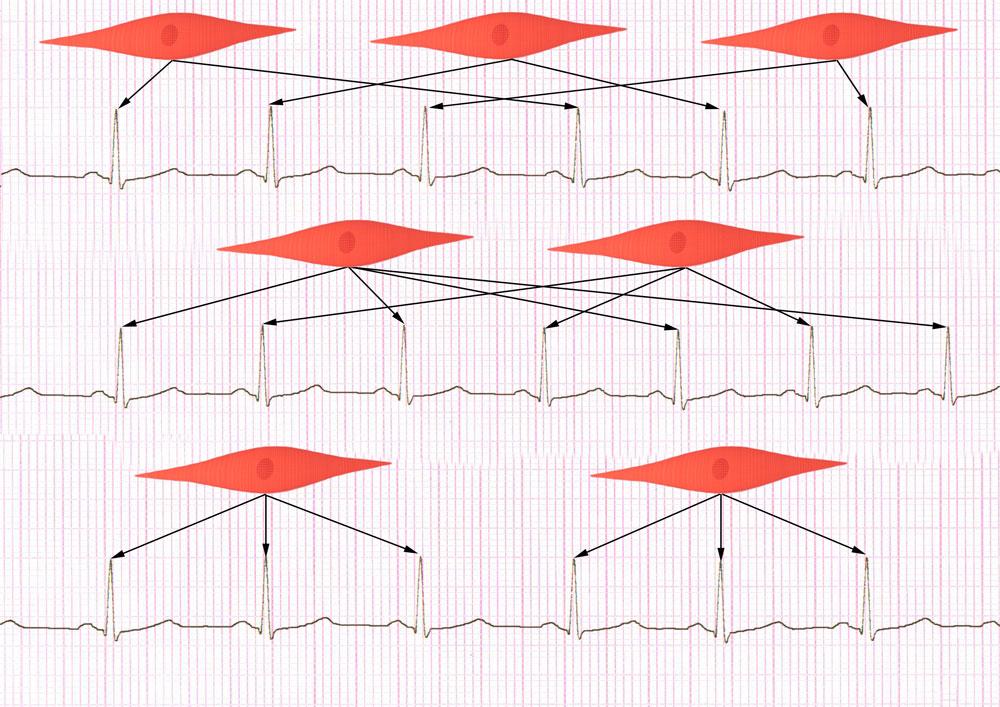
Рисунок 24. Схематическое изображение разных режимов работы кардиомиоцитов в связи с ЭКГ
Видео 10. Разные режимы сокращения кардиомиоцитов
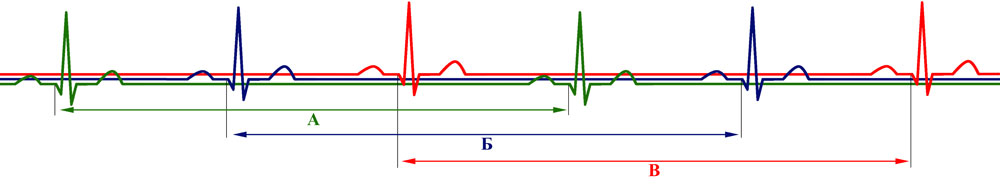
Рисунок 25. Условная схема ЭКГ с комплексами, относящимися к трем разным поочередно работающим группам кардиомиоцитов (А,Б,В)
Видео 11. Изображение «вахтового принципа» работы пучков кардиомиоцитов (посменное сокращение отдельных зон кардиомиоцитов)
Видео 12. Поочередное сокращение пучков кардиомиоцитов
Видео 13. Посменный принцип работы зон кардиомиоцитов (красным цветом выделены ассоциации контрактированных групп), гистологический препарат сердца (окраска гематоксилином и эозином, увеличение x400)
В зависимости от величины нагрузки кардиомиоциты могут работать в разных режимах. Например, значительная нагрузка «включает» мобилизационный режим: работают все кардиомиоциты. Но при таком варианте происходит быстрое истощение энергии клеток, за которым следует обратимая дисфункция миокарда, носящая кратковременный характер — «оглушение» (станнинг) [41]. В дальнейшем происходит адаптивное более длительное снижение функции для поддержания необходимого метаболизма — «спячка» (гибернация) [37]. К тому же, несмотря на накопленный за последнее время опыт, нет точных данных о специфическом механизме определения глубины гибернации — ее степени тяжести с точки зрения морфологии и влияния на сроки восстановления функции. Известно, что чрезмерная и продолжительная нагрузка приводит к дистрофии и некрозу, однако точных сроков поддержания клеток в метаболически устойчивом состоянии, то есть в анабиозе — нет.
Видео 14. Схематическое изображение адаптации кардиомиоцитов к гипоксии
Кардиомиоциты могут долго оставаться жизнеспособными даже при крайней степени гипоксии в результате перехода на анаэробный метаболизм. Это явление заложено в живой природе, когда на Земле еще не было кислорода, и сохраняется в генетической памяти.
Проведены специальные наблюдения развития куриных эмбрионов в условиях изоляции от кислорода. При ограниченном содержании кислорода происходит изменение метаболизма. Результаты этих исследований подтверждают возможность развития сердца куриных эмбрионов в условиях изоляции от обычной атмосферы. Способность к анаэробному метаболизму, регулированию его скорости и использованию имеющихся запасов кислорода определяют жизнеспособность при гипоксии (рисунок 26, видео 15).
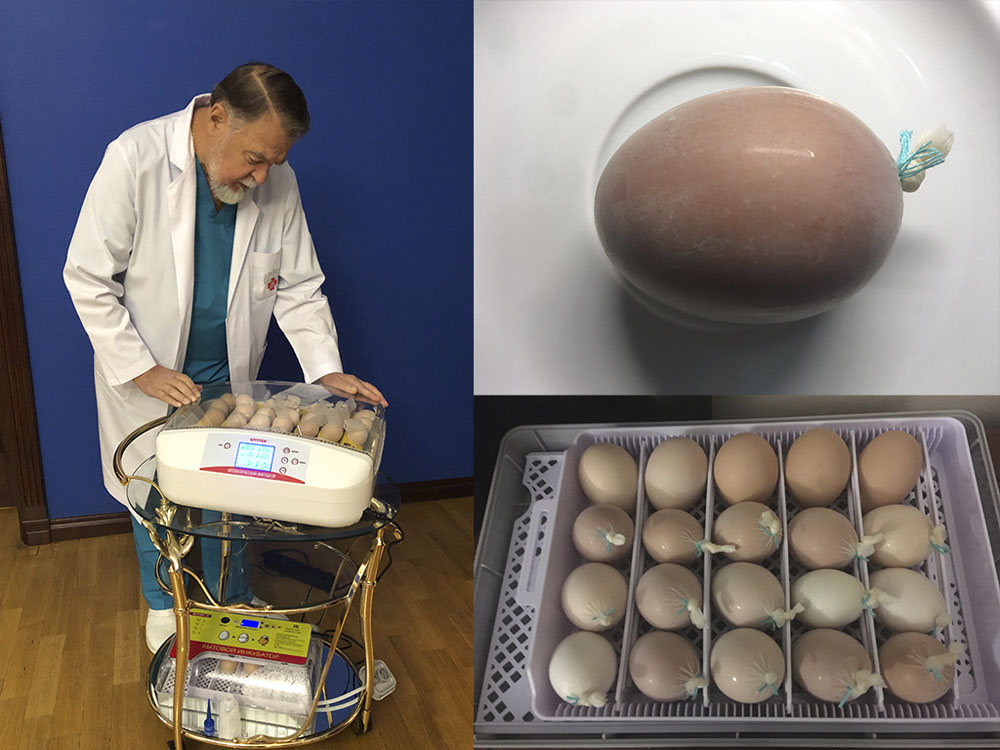
Рисунок 26. Специальные наблюдения развития куриных эмбрионов в условиях гипоксии
Видео 15. Специальные наблюдения развития куриных эмбрионов в условиях гипоксии
Доказательством жизнеспособности живых организмов в условиях низких температур (-
Видео 16. Гибернация в природе
Искусственный станнинг применяется при защите миокарда от гипоксии во время операций на открытом сердце (видео 17).
Видео 17. Операция на сердце
Обеспечивает длительное сохранение жизнеспособности сердца при его транспортировке от донора к реципиенту (видео 18).
Видео 18. Транспортировка сердца от донора к реципиенту
Постоянное возбуждение миокарда при длительном адреналовом стрессе или искусственно вызываемых электроимпульсах (электрокардиостимуляции) лишает миокард способности работать по вышеописанному принципу поочередности сокращений его клеток и их групп. При дефибрилляции происходит остановка несинхронизированной, хаотичной работы кардиомиоцитов в состоянии систолы. Через определенное время сердце восстанавливает работу, но в мобилизационном режиме, то есть сокращаются все кардиомиоциты. А в последующем запускается принцип сменной работы пучков сердечных клеток. Продолжительный же период мобилизации и многократные дефибрилляции приводят к истощению его резервов и развитию дисфункции сердца (острой сердечной недостаточности), которая наблюдается в раннем послеоперационном периоде.
Видео 19. Режимы работы сердца
Заключение
Все вышеприведенное позволяет предположить и в определенной степени объяснить способность сердца на протяжении всей жизни выполнять колоссальную работу, энергии которой хватило бы для полета до Луны и обратно. А с учетом, что структурные единицы сердца (кардиомиоциты) не способны к митозу, то есть к размножению и обновлению, не поддается другому объяснению выполняемая сердцем такая гигантская работа, особенно при мощнейших физических нагрузках, стрессах, болезнях и прочем.
Несомненно, в ближайшем будущем концепция «поочередной работы кардиомиоцитов», как принцип экономного энергосберегающего функционирования органа, будет обоснована теоретически и доказана практически. А результаты этого фундаментального исследования позволят более эффективно управлять работой сердца и надежно сохранять потенциал его долгосрочной деятельности.
Видео 20. Явление поочередного сокращения кардиомиоцитов и их ассоциаций
Список литературы
1. Афанасьева Ю.И., Юрина Н.А. Гистология. – Москва: Медицина, 1999.
2. Берестень Н.Ф. Тканевое допплеровское исследование миокарда. — Москва: Реал Тайм, 2006.
3. Быков В.Л. Цитология и общая гистология (функциональная морфология клеток и тканей человека) – Санкт-Петербург.: СОТИС, 2002.
4. Волкова О.В., Пекарский М.И. Эмбриогенез и возрастная гистология внутренних органов человека. – Москва: Медицина, 1976.
5. Дворецкий И.Х., Соболевский С.И. Древнегреческо-русский словарь: Около 70000 слов (в 2-х томах). – Москва: ГИС, 1958.
6. Карлсон Б. Основы эмбриологии по Пэттену: Пер. с англ. под ред. Б. В. Конюхова. — Москва: Мир, 1983.
7. Лука (Войно-Ясенецкий). Дух, душа и тело. – Москва: Образ, 2011. .
8. Ноздрачев А.Д. Некоторые элементы построения теории метасиматической нервной системы. // Физиол. журн. им. И.М. Сеченова. – 1987. – Т.72. – № 2. – C.190 201.
9. Павлюкова Е.Н., Кужель Д.А., Матюшин Г.В., Савченко Е.А., Филиппова С.А. Ротация, скручивание и раскручивание левого желудочка: физиологическая роль и значение в клинической практике. // Рациональная фармакотерапия в кардиологии. – 2015. – Т. - №1. – С. 68-78.
10. Смирнов В.М. Физиология человека. – Москва: Медицина, 2002.
11. Ткаченко Б.И. Нормальная физиология человека. — 2-е изд. — Москва: Медицина, 2005.
12. Хабарова А.Я. Иннервация сердца и коронарных сосудов – Л.: Наука, 1975.
13. Ченцова Ю.С. Мышечные ткани: учеб. пособие. – Москва: Медицина, 2001.
14. Швалев В.Н., Сосунов А.А., Гуски Г. Морфологические основы иннервации сердца. – М.: Наука, 1992. .
15. Шевченко Ю.Л., Борщев Г.Г., Ульбашев Д.С., Вахромеева М.Н., Вахрамеева А.Ю. Прогнозирование исходов реваскуляризации сердца в зависимости от сократительной способности левого желудочка и количества жизнеспособного миокарда у больных ИБС. // Грудная и сердечно-сосудистая хирургия. – 2020. – Т.62. – № 6. – С.563-570. DOI:10.24022/0236-2791-2020-62-6-563-570
16. Шевченко Ю.Л., Борщев Г.Г., Ульбашев Д.С., Вахромеева М.Н., Вахрамеева А.Ю. Сравнительная оценка данных сцинтиграфии в ближайшие и отдаленные периоды после различных методов коррекции коронарного кровообращения у больных ИБС. // Вестник НМХЦ им Н.И. Пирогова. – 2020. – Т.15. – № 2. – С.16-25. DOI: 10.25881/BPNMSC.2020.89.42.002
17. Ширинский В.П., Хапчаев А.Ю., Степанова О.В. Молекулярные механизмы кардиомиогенеза и перспективы восстановления кардиомиоцитов при сердечной недостаточности. // Молекулярная биология. – 2008. – Т. 42. – №5. – С.856-866.
18. Aoki H., Sadoshima J., Izumo S. Myosin light chain kinase mediates sarcomere organization during cardiac hypertrophy in vitro. Nat. Med. 2000;6:183-188 .
19. Canty J.M.Jr., Fallavollita J.A. Chronic hibernation and chronic stunning: a continuum // J Nucl Cardiol. 2000. Vol. 7. No. 5. pp. 509-27.
20. Canty J.M.Jr, Fallavollita J.A. Lessons from experimental models of hibernating myocardium // Coron Artery Dis. 2001. Vol. 12. No. 5. pp. 371-80. .
21. Chadin A.V., Dudnakova T.V., Stepanova O.V., Shirin-sky V.P. 2006. Kinase-related protein (telokin) is involved in sarcomerogenesis in chicken embryo cardi-omyocytes. J. Muscle Res. Cell Motil. 27: 503.
22. Cingolani H.E., Perez N.G., Cingolani O.H., Ennis I.L. The Anrep effect: 100 years later. Am J Physiol Heart Circ Physiol. 2013;304(2):H175-82. doi: 10.1152/ajpheart.00508.2012.
23. Coote J.H., Chauhan R.A. The sympathetic innervation of the heart: Important new insights. Auton Neurosci. 2016;199:17-23. doi: 10.1016/j.autneu.2016.08.014.
24. Dabiri G.A., Turnacioglu K.K., Sanger J.M., Sanger J.W. 1997. Myofibrillogenesis visualized in living embryonic cardiomyocytes. Proc. Natl. Acad. Sci. USA. 94:9493-9498.
25. Drose J.A. Fetal Echocardiography. – Elsevier Health Sciences, 2010 .
26. Du A., Sanger J.M., Linask K.K., Sanger J.W. Myofibrillogenesis in the first cardiomyocytes formed from isolated quail precardiac mesoderm. Dev. Biol. 2003;257: 382-394.
27. Ellison J.P., Williams T.H. Sympathetic nerve pathways to the human heart and their variations. Amer. J. Anat. 1969; 124(2):149-162.
28. Gatt A., Agarwal S., Zito P.M. Anatomy, Fascia Layers. – StatPearls Publishing; 2021.
29. Giordano C., Kuraitis D., Beanlands R.S., Suuronen E.J., Ruel M. Cell-based vasculogenic studies in preclinical models of chronic myocardial ischaemia and hibernation // Expert Opin Biol Ther. 2013. Vol. 13. No. 3. pp. 411-28.
30. Guyton A.C., Hall J.E. Textbook of Medical Physiology — 11th edition. — Philadelphia: Elsevier Saunders; 2008
31. Hocum Stone L.L., Swingen C., Wright C., Qi S.S., Rassette M., McFalls E.O., Kelly R.F. Recovery of hibernating myocardium using stem cell patch with coronary bypass surgery // The Journal of thoracic and cardiovascular surgery. 2021. Vol. 162. No. 1. pp. e3–e16.
32. Hutter O.F. The vagus and the heart: revisiting an early contribution to a still on-going dispute. J Physiol. 2012; 15;590(10):2535-6. doi: 10.1113/jphysiol.2012.227801.
33. Janig W. Transmission of impulses in the parasympathetic cardiomotor pathway to the sino-atrial node. J Physiol. 2011;589 (Pt 24):5911-3. doi: 10.1113/jphysiol.2011.223255.
34. Karemaker J.M., Wesseling K.H. Variability in cardiovascular control: the baroreflex reconsidered. Cardiovasc Eng. 2008 Mar;8(1):23-9. doi: 10.1007/s10558-007-9046-4.
35. Kobirumaki-Shimozawa F., Inoue T., Shintani S.A., et al. Cardiac thin filament regulation and the Frank-Starling mechanism. The journal of physiological sciences. 2014;64(4): 221–232. https://doi.org/10.1007/s12576-014-0314-y .
36. Koeppen B.M., Stanton B.A. Berne Levy Physiology. — 6th edition. — Philadelphia: Mosby Elsevier; 2008.
37. Marongiu E., Crisafulli A. Cardioprotection acquired through exercise: the role of ischemic preconditioning // Curr Cardiol Rev. 2014. Vol. 10. No. 4. pp. 336-348.
38. Mukhametov L.M., Supin A.Y., Polyakova I.G. Interhemispheric asymmetry of the electroencephalographic sleep patterns in dolphins // Brain Res. 1977. Vol. 134. № 3. P. 581–584 .
39. Nerbonne J.M., Kass R.S. Molecular Physiology of Cardiac Repolarization. Physiological Reviews. 2005;85(4):1205—1253. doi:10.1152/physrev.00002.2005.
40. Pakkam M.L., Brown K.N. Physiology, Bainbridge Reflex. 2022. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 .
41. Paul A.K., Hasegawa S., Yoshioka J., Mu X., Maruyama K., Kusuoka H., Nishimura T. Characteristics of regional myocardial stunning after exercise in gated myocardial SPECT // J Nucl Cardiol. 2002. Vol. 9. No. 4. pp. 388-94.
42. Salvage S.C., Huang C.L-H., Jackson A.P. Cell-Adhesion Properties of β-Subunits in the Regulation of Cardiomyocyte Sodium Channels. Biomolecules. 2020;10(7):1-22. doi:10.3390/biom10070989.
43. Shevchenko Yu.L. Experimental Validation of Embryonic Cardiomyocyte Implantation in Complex Therapy of Myocardial Failure. Progress in Biomedical Research. 1999;4(5):468-474.
44. Smith O.A. Reflex and central mechanisms involved in the control of the heart and circulation. Annu Rev Physiol. 1974;36:93-123. doi: 10.1146/annurev.ph.36.030174.000521.
45. Whiting A., Wardale J., Trinick J. 1989. Does titin regulate the length of muscle thick filaments? J. Mol. Biol. 205: 263-268 .
46. Wu Q.Q., Xiao Y., Yuan Y., et al. Mechanisms contributing to cardiac remodelling. Clin Sci (Lond). 2017;24;131(18):2319-2345. doi: 10.1042/CS20171167 .