Даминов В.Д., Рыбалко Н.В., Горохова И.Г., Зимина Е.В., Кузнецов А.Н.
ВВЕДЕНИЕ
Реабилитация больных с двигательными нарушениями вследствие заболеваний и травм ЦНС является одной из наиболее актуальных проблем современной медицины, так как именно патология движения является основной причиной инвалидизации при наиболее значимых в социальном плане заболеваний [1 — 3, 5].
Принципиально новым направлением моторной реабилитации является метод внешней реконструкции ходьбы с применением роботизированных комплексов ERIGO и LOKOMAT (Hocoma, Швейцария), обладающих широкими возможностями моделирования движений больного в реальном масштабе времени [2, 4, 6 — 10]. Аппаратный комплекс ERIGO представляет собой традиционный стол — вертикализатор, объединенный с роботизированной системой ходьбы. Движения ног соответствуют физиологическому движению бедренного, коленного и голеностопного суставов, что особенно актуально для данного контингента. Результаты тренинга сохраняются в компьютере в цифровом и графическом вариантах, что позволяет проследить динамику показателей у каждого пациента.
Цель исследования — изучение функциональных изменений нервной системы и их корреляция с динамикой неврологического дефицита у пациентов с двигательными нарушениями центрального генеза при использовании метода внешней реконструкции ходьбы на роботизированной системе ERIGO. Большая распространенность как сосудистых заболеваний головного мозга, так и травм ЦНС побудили включить в исследование две группы больных с различным уровнем (церебральный и спинальный) поражения ЦНС.
МАТЕРИАЛЫ И МЕТОДЫ
Характеристика групп больных
В 1 группу были включены 29 пациентов (18 мужчин и 11 женщин) в остром периоде полушарного ишемического инсульта. В клинической картине у всех пациентов определялся гемипарез различной степени выраженности (от 4 баллов до плегии). Период от развития инсульта до начала реабилитации составили 3,4+1,1 суток. Группу 11 составили 39 больных (мужчин — 76%, женщин — 24%) в промежуточном периоде спинно — мозговой травмы (давность травмы 2,3+0,4 мес.) на грудном и поясничном уровнях с синдромом неполного нарушения проводимости. В клинической картине у всех пациентов определялся нижний спастический парапарез различной степени выраженности (от 4 баллов до плегии). Средний возраст составил 31,3+2,6 лет. Всем больным была проведена операция по декомпрессии спинного мозга и стабилизации позвоночника.
Противопоказаниями для включения в исследование являлись: выраженная нестабильность гемодинамики, пролежни в местах соприкосновения с креплениями, тяжелые контрактуры тазобедренных, коленных и голеностопных суставов, тромбоз нижних конечностей.
Методы обследования пациентов
Всем пациентам, перенесшим ишемический инсульт проводился неврологический осмотр с использованием «Шестибалльной шкалы оценки мышечной силы» и «Индекса Активностей Повседневной жизни Бартела» (Bartel ADL INDEX).
Неврологический дефицит спинальных пациентов оценивался при помощи 5 ранговой шкалы Американской Ассоциацией Спинальной Травмы (ASIA).
Для оценки функционального состояния головного мозга и динамики компенсаторно-приспособительных процессов в ЦНС применялся метод вызванных потенциалов (ВП). Исследование коротколатентных сомато — сенсорных вызванных потенциалов (ССВП) проводили при чрескожной стимуляции срединного и большеберцового нервов «прямоугольным импульсом» на уровне запястья и внутренней части лодыжки в двух сериях с помощью аппарата Viking-Quest (Nicolet,USA).
Для оценки системной гемодинамики проводилась импедансная кардиография на аппарате Cardioscreen 1000 (Niccomo PC). Данный метод применялся для неинвазивных гемодинамических измерений и мониторинга гемодинамических параметров на основании определения синхронизированных с пульсом колебаний кровотока и объема в грудной аорте. Регистрировались изменения в электрическом сопротивлении (импедансе) грудной клетки по отношению к электрическому переменному току.
Транскраниальная магнитная стимуляция (ТМС) с определением латентности, амплитуды и времени центрального моторного проведения (ВЦМП) проводилась с использованием магнитного стимулятора MagStim 250 (BiStim), позволяющего получать двойные импульсы с межстимульным интервалом до 1 мс (1000 Гц) и максимальной частотой парных стимулов 0,2 Гц.
Клинико-неврологическое и нейрофизиологическое обследования проводились всем пациентам в начале курса лечения и по его завершению. Статистический анализ выполняли с помощью программного пакета SРSS (определение достоверности по T-тесту для независимых выборок (t), выявление величины силы взаимосвязи между переменными — линейный регрессионный анализ с расчетом коэффициента детерминации (R).
Методы лечения
А. Программы реабилитации больных в остром периоде полушарного ишемического инсульта
В зависимости от содержания лечебного комплекса больные были разделены на статистически однородные по возрасту, длительности заболевания, клиническим проявлениям группы: группа IА (n=18), группа IIА (n=11). Всем больным группы IА проводилось стандартизированное восстановительное лечение (медикаментозная терапия, лечебная физкультура, массаж, механотерапия, функциональная электростимуляция) с включением в него занятий на роботизированной системе ERIGO. Тренировочная процедура у больных основной группы проводилась по схеме: ежедневно от 20 до 30 минут в течение 20 лечебных дней. Режим тренировок подбирался индивидуально, в зависимости от толерантности к нагрузке. В процессе первых трех занятий осуществлялся пошаговый перевод пациента в вертикальное положение от 10 до 30 градусов при скорости 38 — 40 шагов в минуту. Нагрузка на нижние конечности была либо пассивной, либо пассивно-активной. В последующие три занятия больные постепенно переводились в вертикальное положение до 60 градусов при скорости 40 — 56 шагов в минуту. На этом восстановительном этапе перед пациентами ставились максимально- выполнимые задачи для достижения тренировочного эффекта учитывая клинические и нейрофизиологические показатели обследования пациентов. В последующие 14 занятий пациенты вертикализировались до 80 градусов. Объем выполняемых нагрузок закреплялся и постепенно увеличивался. Больные группы IIА получали комплексное лечение, не содержащее роботизированной механотерапии, и составили группу контроля.
Б. Программы реабилитации больных в промежуточном периоде спинно — мозговой травмы.
В зависимости от содержания программы реабилитации пациенты были разделены на две группы: группа IБ (n=22) и группа IIБ (n=17). Группы были статистически однородными по возрасту, длительности заболевания и клиническим проявлениям. Всем пациентам группы IБ проводилось комплексное восстановительное лечение, состоящее из медикаментозной терапии, лечебной физкультуры, массажа, механотерапии, функциональной электростимуляции с включением в него тренировочных занятий на роботизированной системе ERIGO. Режимы тренировки подбирались строго индивидуально в зависимости от исходных возможностей пациента и от толерантности к нагрузке. Занятия на Erigo проводились один раз в день в течение 20 дней. Непосредственно перед началом тренировки оценивался исходный уровень пациента и, исходя из полученных значений, выставлялись параметры нагрузки. Первые тренировки начинались в горизонтальном положении или с минимальным углом подъема —
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
А. Результаты лечения пациентов в остром периоде ишемического инсульта.
На момент начала восстановительной терапии степень пареза составляла в IА группе 2,84±0,24 балла и во IIА группе 2,79±0,31 балла, средний угол подъема ноги в коленном суставе составлял 8,4±1,7 градусов у пациентов I группы и 7,7±1,6 градусов у пациентов группы II. Индекс Бартела в
На фоне проведенного лечения анализ изменения двигательной функции отобразил положительную динамику у пациентов обеих групп. Изменения мышечной силы в паретичной конечности, определяемые по «Шестибалльной шкале оценки мышечной силы», представлены в таблице 1.
Таблица 1
Динамика мышечной силы в паретичной нижней конечности (в баллах)
|
Группы |
Кол — во больных |
Мышечная сила |
|
|
До лечения |
После лечения |
||
|
Группа IА |
(n=18) |
2,84±0,24 |
3,72±0,17* |
|
Группа IIА |
(n=11) |
2,79±0,31 |
3,21±0,44 |
* - значимость различий с исходными данными р<0.05
Как видно из таблицы 1, уменьшение степени пареза отмечено в обеих исследуемых группах, однако, достоверными являются различия только у пациентов группы IА.
В результате лечения достоверно значимая (р<0,05) динамика амплитуды движений на стороне поражения определялась как в основной, так и в контрольной группах. Средний угол подъема паретичной ноги в коленном суставе у пациентов IА группы увеличился с 8,4±1,7 до 30,2±2,4 градусов у пациентов II группы с 7,7±1,6 до 18,5±1,8 градусов у пациентов группы IIА.
Анализ индекса повседневной активности выявил достоверно значимые (р<0,05) различия между группами. Так, средний прирост баллов по шкале Бартела у пациентов IА группы составил 22 балла, у пациентов IIА группы — 8 баллов (рис. 1).
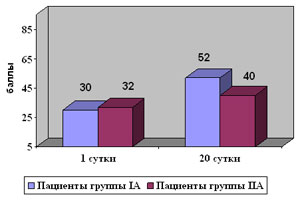
Рис. 1. Средние величины индекса Бартела у пациентов IА и IIА групп.
В результате проведенного лечения получены значимые различия между динамикой нейрофизиологических данных больных основной и контрольной групп.
У 8 пациентов из основной группы появился корковый ответ, латентностью — 40,1±0,6 при стимуляции n.tibialis и у 7 пациентов, латентностью — 27,2±0,4 при стимуляции n.medianus. В группе контроля корковый ответ был выявлен лишь у 1 больного, латентностью — 39,7 мс при стимуляции n.tibialis и у 2 пациентов, латентностью — 28,0±0,7 при стимуляции n.medianus (табл.2).
Таблица 2
Динамика латентности (мс) при стимуляции n.medianus и n.tibialis.
|
Тип ответа |
До лечения |
После лечения |
||
|
Группа IА |
Группа IIА |
|||
|
n.medianus |
Корковый |
Не получен |
27,2± 0,4 |
28,0± 0,7 |
|
Сегментарный |
14,4± 0,9 |
10,1± 0,3* |
13,2± 0,8 |
|
|
n.tibialis |
Корковый |
Не получен |
40,1± 0,6 |
39,7± 0,6 |
|
Сегментарный |
26,7± 0,4 |
21,3± 0,4* |
25,9± 0,9 |
|
* - значимость различий с исходными данными р<0.05
Латентность сегментарного ответа претерпела более значимые изменения (табл. 2). Достоверно значимое снижение латентности ответа плечевого (с 14,4±0,9мс до 10,1±0,3мс) и поясничного (с 26,9±0,7мс до 21,3±0,4мс) зарегистрированы в IА группе. В группе IIА показатели также улучшились, однако, не достигли достоверно значимых отличий с исходными: латентность ответа плечевого сплетения снизилась до 13,2±0,8; поясничного сплетения — до 25,9 0± 0,9 мс.
При проведении процедуры восстановительной механотерапии не выявлено выраженных и стойких изменений показателей системной гемодинамики (систолическое и диастолическое артериальное давление, ударный объем, работа левых отделов сердца). Во время тренировки артериальное давление не достигало критических значений. В ряде случаев на
Б. Результаты лечения больных в промежуточном периоде спинно — мозговой травмы.
У всех обследованных больных имелись двигательные расстройства, представленные нижним парапарезом различной степени выраженности. Степень неврологического дефицита всех пациентов соответствовала рангу В или С по шкале ASIA. В группе IБ из 22 пациентов 17 были адаптированы к инвалидной коляске и не могли стоять или ходить без помощи, и только 5 были способны шагать по лестнице. В группе IIБ из 17 пациентов 4 больных были не в состоянии ходить.
По данным ТМС при тестировании коркового представительства большеберцовых мышц получен вызванный моторный ответ (ВМО) с латентностью 61,3+2,2 мс и амплитудой 0,3+0,04 мВ. Латентность и амплитуда сегментарного ответа составили 18+2,3 мс и 1,2+0,6 мВ, соответственно (табл. 3).
По завершении курса лечения в группе IБ из 17 больных, которые были не в состоянии ходить до тренировки, 9 обрели способность ходить без посторонней помощи, у 6 пациентов наблюдалось улучшение способности передвигаться с посторонней помощью, и только у
В результате проведенного лечения получены различия между динамикой нейрофизиологических данных больных основной и контрольной групп. При этом динамика характеристик коркового ВМО не достигла достоверно значимых изменений (табл. 3).
Таблица 3
Данные ТМС коры и поясничного сплетения при регистрации в стандартных точках m. tibialis anterior до и после лечения
|
Параметр |
До лечения |
После лечения |
||
|
Группа IБ |
Группа IIБ |
|||
|
Латентность, мс |
Корковый ВМО |
61,3+2,2 |
56,4+1,3 |
57,2+2,3 |
|
Сегментарный ВМО |
18,2+2,3 |
10,4+1,1* |
16,4+1,8 |
|
|
Амплитуда, мВ |
Корковый ВМО |
0,36+ 0,04 |
0,49+ 0,02 |
0,42+0,03 |
|
Сегментарный ВМО |
1,2+0,6 |
3,5+0,6* |
1,6+0,2 |
|
— * - различия до и после лечения являются значимыми (p<0,05)
В то же время латентность и амплитуда сегментарного ответа претерпели значимые изменения (табл 3). Достоверно значимое снижение латентности при увеличении амплитуды ответа зарегистрированы в группе IБ. В группе IIБ данные показатели также улучшились, однако не достигли достоверно значимых отличий с исходными данными.
ЗАКЛЮЧЕНИЕ
Таким образом, эффективность локомоторной тренировки на роботизированной системе ERIGO превышает эффекты традиционной кинезотерапии в плане восстановления двигательных функций, нарушенных в результате поражения головного и спинного мозга. Так же выявлена корреляция между регрессом клинических симптомов и позитивной динамикой нейрофизиологических показателей. Все это дает веские основания для более активного использования роботизированного комплекса ERIGO в реабилитации пациентов неврологического профиля и дальнейшего изучения эффективности данного метода.
ЛИТЕРАТУРА
- Кокоткина Л.В. Нейропсихологический статус больных травматической болезнью спинного мозга на стационарном этапе реабилитации / Кокоткина Л.В., Кочетков А.В., Костив И.М., Цыганков Б.Д. // Журн. Курортные ведомости. — 2008. — № 3. — С.
101-102.. - Кочетков А.В. Роботизированная локомоторная терапия больных травматической болезнью спинного мозга / Кочетков А.В., Бородин М.М., Костив И.М., Пряников И.В., Кочунева О.Я., Горбешко Г.А. // Журн. Курортные ведомости. — 2008. — № 3. — С. 110 —111.
- Мусаев А.В.Исследование качества жизни в лечении и реабилитации неврологических больных / Мусаев А.В., Гусейнова С.Г., Имамвердиева С.С., Мустафаева Э.Э., Мусаева И.Р. // Журн. Вопросы курортологии, физиотерапии и лечебной физкультуры. — 2006. — № 1. — С.13 — 19.
- Черникова Л.А. Эффект применения роботизированных устройств ( «Эриго» и «Локомат») в ранние сроки после ишемического инсульта / Черникова Л.А., Демидова А.Е., Домашенко М.А. // Журн. Вестник Восстановительной медицины. — 2008. — № 5. — С.
73-75.
5. Кадыков А.С. Реабилитация неврологических больных / А.С.Кадыков, Л.А.Черникова, Н.В.Шахпаронова. — М.: МЕДпресс-информ, 2008. — 560с.: ил.
6. Hidler JM, Wall AE. Alterations in muscle activation patterns during robotic-assisted walking. Clin Biomech (Bristol, Avon). 2005 Feb; 20(2):184-93.
7. Hornby TG, Zemon DH, Campbell D.Robotic-assisted, body-weight-supported treadmill training in individuals following motor incomplete spinal cord injury. Physical Therapy 2005; 85(1):52-66.
8. Mirbagheri MM, Tsao C, Pelosin E, Rymer WZ. Therapeutic Effects of Robotic-Assisted Locomotor Training on Neuromuscular Properties. Proceedings of the IEEE 9th International Conference on Rehabilitation Robotics (ICORR), Chicago USA,
9. Walsh T, Cotter S, Boland M, Greally T, O’Riordan R, Lyons D: Stroke unit care is
superior to general rehabilitation unit care. Ir Med J 2006;
10. Winchester P, McColl R, Querry R, Foreman N, Mosby J, Tansey K, Williamson J. Changes in supraspinal activation patterns following robotic locomotor therapy in motor-incomplete spinal cord injury. Neurorehabil Neural Repair 2005; 19: