Виноградов О.И., Кузнецов А.Н. Национальный центр патологии мозгового кровообращения Национального медико-хирургического центра им. Н.И.Пирогова
В настоящее время ведущей причиной лакунарного инфаркта (ЛИ) головного мозга считается церебральная микроангиопатия на фоне артериальной гипертензии. Однако появляются данные, что эмболия в церебральные перфорантные артерии также может приводить к ЛИ. Целью настоящего исследования было определить может ли лакунарный инфаркт головного мозга развиться вследствие кардиогенной или артерио-артериальной эмболии в перфорантные артерии, а также уточнить критерии диагностики различных этиопатогенетических вариантов ЛИ. Нами было обследовано 211 больных ЛИ (97 мужчин и 114 женщин в возрасте от 38 до 84 лет). Пациенты были разделены на 2 группы: I группа — больные ЛИ без потенциальных источников церебральной эмболии — 179 пациентов (84,8%); II группа — больные ЛИ с верифицированным потенциальным источником церебральной эмболии — 32 пациента (15,2%). Проведенное исследование показало, что особенности клинической картины не позволяют судить о причине лакунарного инфаркта. Изолированная оценка факторов риска инсульта без оценки результатов лабораторно-инструментальных исследований, также не позволяет определить механизм развития ЛИ. Для больных с эмболическим генезом ЛИ характерно: наличие потенциальных источников кардиальной и артерио-артериальной эмболии; микроэмболические сигналы по данным допплеровского мониторинга церебральных артерий; выраженный неврологический дефицит; множественные лакунарные очаги в нескольких сосудистых бассейнах или несколько крупных очагов (более 15 мм) в одном сосудистом бассейне, либо сочетание лакунарных и территориальных очагов по данным МРТ в диффузионном режиме. Выполненное нами исследование подтвердило возможность эмболического генеза ЛИ. Верификация истинной причины, приведшей к фокальному церебральному повреждению, необходима для выбора адекватного метода вторичной профилактики ЛИ. Ключевые слова: лакунарный инфаркт, эмболия
Лакунарным называется ишемический инфаркт головного мозга, ограниченный территорией кровоснабжения одной из малых перфорантных артерий, расположенный в глубинных отделах полушарий или ствола головного мозга. В процессе организации лакунарного инфаркта формируется полость округлой формы, заполненная ликвором — лакуна. Доля лакунарного инфаркта (ЛИ) головного мозга среди других подтипов ишемического инсульта составляет по данным различных авторов от 13% до 37% (в среднем, около 20%) [8,10,11, 13, 19]. В 80% случаев, ЛИ протекает асимптомно [14]. Для лакунарного патогенетического подтипа ишемического инсульта характерно: 1) клиническая картина инсульта проявляется одним из традиционных «лакунарных» синдромов; 2) данные КТ/МРТ нормальные или имеются субкортикальные/стволовые повреждения диаметром менее 1,5 см [8]. Впервые термин «лакуна» употребил невролог Durand-Fardel M., который опубликовал в 1843 г. в Париже свой трактат о «размягчении» мозга, основанный на 78 патологоанатомических наблюдениях. Он писал: «В стриатуме с каждой стороны видны маленькие лакуны ..., поверхности которых связаны с очень маленькими сосудами». Он считал, что эти изменения являются следствием воспалительного процесса в головном мозге [14]. В последующем Virchow R. высказал предположение, что дебют инфаркта головного мозга связан с изменением в стенке церебральных артерий, а тромбоз артерии связан с атероматозным поражением сосудистой стенки. Он также впервые указал на возможность тромбоза сосуда вследствие атеросклеротического процесса и эмболии [2]. В 1902 году Ferrand"s J. опубликовал монографию, в которой были проанализированы данные патологоанатомического исследования 50 пациентов с постмортально верифицированными лакунами. Ferrand«s J. постулировал, что к каждой лакуне ведет центрально расположенный сосуд, который, однако, ни в одном из наблюдений не был закупорен. Он обнаружил, что просвет перфорантных артерий сужен, а стенки их утолщены, и считал, что данные изменения приводили к прижизненной окклюзии сосуда, которая нивелировалась в процессе танатогенеза. Вторым важным открытием явилось утверждение, что изменение в стенке мелких артерий могут быть не только причиной их окклюзии и развития ишемического инсульта, но и разрыва, и, как следствие, дебюта геморрагического инсульта [16]. В 1965 году Fisher C. доложил о результате 114 патологоанатомических исследований, где были верифицированы 376 церебральных лакун. Автор дал определение ЛИ: «... это маленькие глубинно расположенные в головном мозге ишемические очаги, формирующие непостоянные полости
Материал и методы:
Нами было обследовано 211 больных лакунарным ишемическим инсультом, находившихся на обследовании и лечении в Пироговском Центре в период с 2003 по 2008 гг. Среди обследованных больных было 97 мужчин и 114 женщин в возрасте от 38 до 84 лет, средний возраст составил 61,2±12,2 года. Пациенты были разделены на 2 группы: I группа — больные ЛИ, у которых в результате обследования не были выявлены потенциальные источники церебральной эмболии — 179 пациентов (84,8%); II группа — больные ЛИ, у которых в результате обследования были выявлены потенциальные источники церебральной эмболии — 32 пациента (15,2%). Пациенты I группы были разделены на две подгруппы: Iа — больные ЛИ с длительным анамнезом гипертонической болезни — 99 пациентов; Iб — больные ЛИ с грубым атеросклеротическим поражением церебральных артерий или дислипидемией — 80 пациентов. Iа группа была условно названа как группа пациентов ЛИ вследствие гипертонической микроангиопатии, Iб группа — вследствие атеросклеротической микроангиопатии, II группа — пациенты с эмболическим генезом ЛИ. Группы были равнозначны по возрасту, процентному соотношению мужчин и женщин. У всех больных клиническая картина была представлена одним из лакунарных синдромов. Всем пациентам выполнялось:
- оценка факторов риска развития инсульта;
- компьютерная томография головного мозга («Somatom Sensation 4», Siemens, Германия);
- магнитно-резонансная томография головного мозга («Giroscan Intera Nova», Philips, Голландия);
- трансторакальная или трансэзоаагеальная эхокардиография («Vivid 7», General Electric, США);
- дуплексное сканирование («Vivid 7», General Electric, США) или селективная ангиография («Infinix CS-1», Toshiba, Япония) брахиоцефальных и церебральных артерий;
- транскраниальная допплерография с билатеральной локацией средних мозговых артерий в течение 60 мин и детекцией микроэмболических сигналов («Sonomed-300», Спектромед, Россия);
- лабораторная диагностика биохимических показателей крови («Olympus 640», Olympus, Япония) и свёртывающей системы крови («BCT DADE», Behring, Германия);
- оценка тяжести неврологического дефицита по шкале NIHSS.
Лакунарный инфаркт головного мозга у всех пациентов клинически манифестировал одним из классических лакунарных синдромов. Наиболее часто встречался «чисто двигательный инсульт»: в I группе — у 106 пациентов (59,2%), во II — у 20 пациентов (62,5%), статистически значимые различия в инцидентности изолированного гемипареза между группами отсутствовали (р>0,05). Синдромы дизартрии с неловкостью руки, сенсорно-моторный инсульт, атактический гемипарез, чисто чувствительный инсульт встречались реже, и по частоте встречаемости также не обнаружили статистически значимых различий между группами. Тяжесть неврологического дефицита в остром периоде инсульта оценивалась по шкале NIHSS. В дебюте заболевания выраженность неврологического дефицита была большей в группе больных ЛИ, у которых выявлены потенциальные источники церебральной эмболии (7,1±2,5 балла) по сравнению с I группой (5,6±2,4 балла), что обнаружило статистически значимые различия (р<0,05). Тяжесть неврологического дефицита через 21 день после дебюта ЛИ во II группе по сравнению с первым днем заболевания была достоверно ниже и составила 5,0±2,5 (р<0,01). В I группе выраженность неврологической симптоматики через 21 день по сравнению с первым днем инсульта также достоверно снизилась — 3,6±2,1 (р<0,01). Однако тяжесть неврологического дефицита в группе больных с верифицированными источниками церебральной эмболии через 21 день оставалась выше, чем у больных ЛИ вследствие церебральной микроангиопатии, что достигло уровня статистически значимых различий (р<0,01). Нами были изучены факторы риска развития лакунарного инсульта в обеих группах. Артериальная гипертензия чаще имела место у больных ЛИ, у которых отсутствовали потенциальные источники церебральной эмболии — 163 пациента (91,1%), по сравнению пациентами II группы — 26 пациентов (81,3%, р<0,05). Анализ инцидентности АГ в подгруппах показал, что в Iа группе она присутствовала у 99 пациентов (100,0%), что обнаружило статистически значимые различия с I б подгруппой — 64 пациента (80,0%, р<0,01) и группой больных с верифицированными потенциальными источниками церебральной эмболии ЛИ — 26 пациентов (81, 3%, р<0,01). Сахарный диабет в I группе был диагностирован у 37 пациентов (20,6%), в группе пациентов с ЛИ и эмболическими источниками — у 12 пациентов (37,5%), что обнаружило статистически значимые различия (р<0,01). Анализ в подгруппах показал, что СД в Iа группе имел место у 13 пациентов (13,1%), в Iб группе — у 24 пациентов (30,0%, р<0,01). У пациентов с ЛИ вследствие гипертонической микроангиопатии СД встречался достоверно реже, чем у больных с эмболическим генезом ЛИ (р<0,01). Инцидентность СД у больных ЛИ вследствие атеросклеротической микроангиопатии была сопоставима с пациентами II группы (р>0,05). Повышенное содержание холестерина или липопротеидов низкой плотности в I группе было обнаружено у 118 больных (65,9%), во II группе — у 28 больных (87,5%), что обнаружило статистически значимые различия (р<0,05). Анализ в подгруппах показал, что дислипидемия имела место у 43 пациентов (49,5%) в группе больных ЛИ с гипертонической микроангиопатией и у 75 пациентов (93,8%) в группе больных с атеросклеротической микроангиопатией, причем значимость различий была достоверна (р<0,01). У пациентов с ЛИ вследствие гипертонической микроангиопатии дислипидемия встречалась значительно реже, чем у больных с эмболическим генезом ЛИ (р<0,01). У больных ЛИ вследствие атеросклеротической микроангиопатии частота встречаемости дислипидемии была сопоставима с пациентами II группы (р>0,05). Частота встречаемости АГ, СД и дислипидемии в группах больных ЛИ представлена в таблице 1. Различий между группами по таким факторам риска, как курение, злоупотребление алкоголем, ожирение и низкая физическая активность не было обнаружено. Гемодинамически значимое атеросклеротическое поражение брахиоцефальных артерий (стеноз >50%) верифицировано у 42 больных ЛИ, в подгруппе больных с атеросклеротической микроангиопатией — у 28 пациентов (38,9%), в группе больных с эмболическим генезом ЛИ — у 14 (46,7%), причем различия не достигли уровня статистической значимости (р>0,05). Необходимо отметить, что в Iб подгруппе у 6 пациентов (8,3%) обнаружена окклюзия сонной артерии, а у оставшихся 22 пациентов стеноз каротидной артерии был расположен контралатерально аффектированному бассейну. Во II группе стенозирующее поражение сонных артерий у всех больных было расположено ипсилатерально пораженному полушарию. В подгруппе больных ЛИ вследствие гипертонической микроангиопатии не наблюдалось грубого стено-окклюзирующего поражения церебральных артерий. Потенциальные кардиальные источники церебральной эмболии были выявлены у 18 пациентов. С наибольшей инцидентностью встречались следующие донорские источники эмболов: ушко левого предсердия (при мерцательной аритмии), фокальная или локальная патология движения стенки миокарда, аневризма левого желудочка, поражение митрального или аортального клапанов сердца. Все источники кадиогенной эмболии были верифицированы у больных II группы. Микроэмболические сигналы при билатеральном допплеровском мониторинге средних мозговых артерий были обнаружены у 32 больных с лакунарным патогенетическим подтипом ишемического инсульта (рис. 1). В группе больных с эмболическим генезом ЛИ, микроэмболы детектированы у 18 пациентов (56,3%), что было достоверно больше по сравнению с Iа подгруппой — у 2 пациентов (2,1%, р<0,001) и Iб подгруппой — у 12 пациентов (15,0%, р<0,01). По данным диффузионной МРТ единичный маленький (до 15 мм) лакунарный очаг, либо отсутствие изменений было диагностировано у 137 пациентов (64,9%) (рис. 2). Среди них превалировали больные ЛИ вследствие гипертонической микроангиопатии — 84 пациента (84,9%) и атеросклеротической микроангиопатии — 53 пациента (66,3%), причем различия между группами не были значимыми (р>0,05). Соответствующие изменения МРТ-сигнала отсутствовали в группе с эмболическим генезом ЛИ. По данным диффузионной МРТ большой (более 15 мм) или несколько мелких очагов в одном сосудистом бассейне верифицированы у 39 пациентов (18,5%): в группе больных с эмболическим генезом ЛИ — у 8 пациентов (25,0%), и в подгруппе больных с атеросклеротической микроангиопатией — у 18 пациентов (22,5%), причем различия не были значимыми (р>0,05). В подгруппе больных ЛИ вследствие гипертонической микроангиопатии только у 13 пациентов (13,1%) верифицированы указанные выше изменения, что достигло уровня статистически значимых различий со II группой (р<0,05). По данным диффузионной МРТ множественные очаги в нескольких сосудистых бассейнах или несколько крупных очагов (более 15 мм) в одном сосудистом бассейне были обнаружены у 35 пациентов (16,6%) (рис. 3). Среди них превалировали больные ЛИ эмболического генеза — 24 пациента (75,0%), что имело значимые различия как с подгруппой больных ЛИ вследствие гипертонической микроангиопатии — 2 пациента (2,1%, р<0,0001), так и с подгруппой больных ЛИ вследствие атеросклеротической микроангиопатии — 9 пациентов (11,2%, р<0,0001). Необходимо отметить, что в Iб подгруппе множественные очаги поражения встречались статистически значимо чаще, чем в Iа подгруппе (р<0,01). Результаты исследования МРТ головного мозга в диффузионном режиме в группах больных ЛИ представлены в таблице 2.
Обсуждение
В настоящее время не вызывает сомнений, что именно микроангиопатия перфорантных артерий является ведущей причиной развития ЛИ. В нашем исследовании удельный вес больных, у которых лакунарный инфаркт развился вследствие «болезни малых сосудов» составил 84,8%. Однако оставалось неясным можно ли на основании рутинного лабораторно-инструментального обследования прижизненно верифицировать тип поражения перфорантной артерии — липогиалиноз (замещение мышечной и эластической мембран коллагеном и генерализованное субинтимальное отложение коллагена) на фоне АГ [17] или микроатероматоз вследствие генерализованного атеросклеротического процесса [5]. Этот вопрос имеет существенное значение для выбора режима вторичной профилактики инсульта. Проведенное нами исследование показало, что особенности клинической картины не позволяют судить о причине, которая привела к лакунарному инсульту. С одинаковой частотой «классические» лакунарные синдромы встречались во всех группах обследованных больных. Изолированная оценка факторов риска инсульта без оценки результатов лабораторно-инструментальных исследований также не позволяет определить механизм развития ЛИ. С разной частотой все факторы риска встречались в изучаемых группах больных ЛИ. Для пациентов с гипертонической микроангиопатией было характерно наличие АГ в анамнезе и не характерно присутствие СД и дислипидемии, для пациентов с атеросклеротической микроангиопатией — наличие дислипидемии и СД. Полученные нами данные свидетельствуют о том, что верификация лакунарного патогенетического подтипа ишемического инсульта требует проведения тщательного обследования больного для лучшего понимания этиопатогенеза ЛИ и назначения адекватных режимов вторичной профилактики. В нашем исследовании гипертоническая микроангиопатия была обнаружена у 46,9% обследованных больных ЛИ. Для пациентов с гипертонической микроангиопатией было характерно отсутствие стено-окклюзирующего атеросклеротического поражения брахиоцефальных артерий, что соответствует данным, полученным отечественными исследователями [5]. Так же для таких пациентов не характерно наличие микроэмболических сигналов по данным допплеровского мониторинга церебральных артерий. Так как липогиалиноз поражает в основном мелкие пенетрирующие церебральные артерии
СПИСОК ЛИТЕРАТУРЫ
- Верещагин Н.В., Моргунов В.А., Гулевская Т.С. Патология головного мозга при атеросклерозе и артериальной гипертонии. — М.: Медицина. — 1997.
- Ворлоу Ч.П., Деннис М.С., Ван Гейн Ж, и др. Инсульт: Практическое руководство для ведения больных. — СПб.: Политехника, 1998. — 629 с.
- Е.И. Гусев, А.Н. Коновалова, А.Б. Гехт. Клинические рекомендации. Неврология и нейрохирургия — М.: ГЭОТАР-Медия, 2007. — 368 с.
- Джибладзе Д.Н. Основные неврологические синдромы при закупорке экстракраниального отдела сонной артерии и механизм их возникновения. //Ж. невропатол. и психиатр. им. С.С. Корсакова. — 1986. — № 1. — С.19-23.
- Максимова М.Ю. Малые глубинные (лакунарные) инфаркты головного мозга при артериальной гипертонии и атеросклерозе: Автореф. дис. ... доктор мед. наук. — М., 2002. — 50 с.
- Пирадов М.А., Верещагин Н.В., Лунев Д.К. и др. Гемодинамические факторы риска повторных инфарктов мозга у больных с закупоркой ВСА. //Ж. невропатологии и психиатрии им. С.С. Корсакова. — 1986. — № 1. — С.11-14.
- Шевченко Ю.Л., Одинак М.М., Кузнецов А.Н., Ерофеев А.А. Кардиогенный и ангиогенный церебральный эмболический инсульт (физиологические механизмы и клинические проявления). //М.: ГЭОТАР — Медиа, 2006. — 272с.
- Adams HP Jr, Bendixen BH, Kappelle LJ, Biller J, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Department of Neurology, University of Iowa, Iowa City
52242-1053. Stroke. 1993 Jan;24(1):35-41. - Bakshi R., Wright P.D., Kinkel P.R. et al. Cranial magnetic resonance imaging findings in bacterial endocarditis: The neuroimaging spectrum of septic brain embolization demonstrated in twelve patients. //J. Neuroimaging. — 1999. —Vol.9. — P.78—84.
- Bamford J., Warlow C. Evolution and testing jf the lakunar hypothesis //Stroke. — 1988. Vol.19. — № 9. — P.1074 —1082.
- Boiten J. Lakunar stroke: a prospective clinical and radiological study. //Arch. Gerontol. Geriatr. — 1991. — № 5. — P.258—264.
- Deborah R. MD; Tuhrim, Stanley MD; Weinberger, Jesse M. MD; Rudolph, Steven H. MD. Mechanisms in Lacunar Infarction // Stroke. — 1992. — 23(3). Р.
325-327. - Dozono K., Ishii N., Nishihara Y. et Horie A. An autopsy study of incidence of lacunes in relation to age, hypertension, and arteriolosclerosis. //Stroke. — 1991. Vol.22. — № 8. — P.993—996.
- Durand-Fardel M,: Traite du Ramollissement du Cerveau, Bailliere. Paris: 1843.
- Eskin S.G. Mcintire L.V. Hemodynamic effect on atherosclerosis and thrombosis. //Seminars In Thromb. And Haemostasis. — 1988. Vol.14. — P.170—174.
- Ferrand, J.: Essai sur l"hemiplegie des vieillards. Les lacunes de destintegration cerebrale. Paris Thesis, 1902.
- Fisher CM. Lacunes: small, deep cerebral infarcts. Neurology. 1965;15:
774–784. - Guidelines for Prevention of Stroke in Patients With Stroke and Transient Ischemic Attack, 2006 // Stroke. — 2006. Vol.37. — № 2. — P.577—617.
- Hommel M., Besson G., Le Bas J. et al. Prospective study of lakunar infarction using magnetic resonance imaging.// Stroke. — 1990. Vol.21. — № 4. — P.546—554.
- Lammie GA, Brannan F, Slattery J, Warlow C. Nonhypertensive cerebral small-vessel disease. An autopsy study. Stroke 1997;28(11):2222-9.
- Recommendations for stroke management Update 2003 EUSI //Cerebrovasc Dis. — 2003. —Vol.16. — P.311-337.
- Uehara T., Tabuchi M., Mori E. Occlusive lesions of carotid and intracranial arteries in patients with symptomatic lacunar infarction — evaluation by MR angiography. //Rinsho Shinkeigaku. — 1997. —Vol.37. — № 9. — P.796—801.
- You R, McNeil JJ, O’Malley HM, Davis SM, Donnan GA. Risk factors for lacunar infarction syndromes. Neurology 1995; 45(8):1483-7.
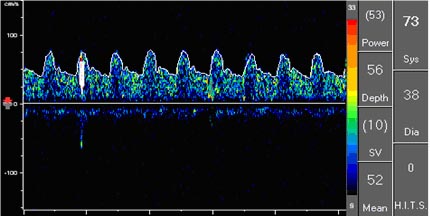 Рис 1. Пациент П, 52 лет.
Рис 1. Пациент П, 52 лет.
Микроэмболический сигнал в правой средней мозговой артерии у пациента с ЛИ на фоне стеноза правой внутренней сонной артерии 80%.
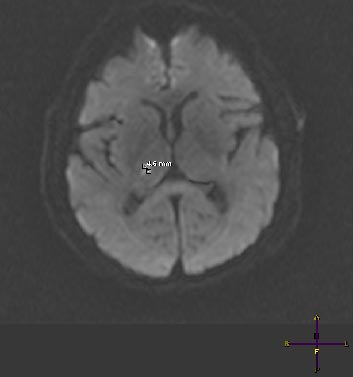 Рис 2. Пациент А., 54 лет. Лакунарный очаг в области правого таламуса по данным МРТ головного мозга в диффузионном режиме, у пациента с ЛИ на фоне артериальной гипертензии.
Рис 2. Пациент А., 54 лет. Лакунарный очаг в области правого таламуса по данным МРТ головного мозга в диффузионном режиме, у пациента с ЛИ на фоне артериальной гипертензии.
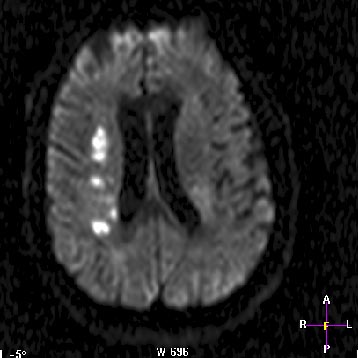 Рис 3. Пациент П, 52 лет. Множественные лакунарные очаги в бассейне правой средней мозговой артерии по данным МРТ головного мозга в диффузионном режиме, у пациента с ЛИ на фоне стеноза правой внутренней сонной артерии 80%.
Рис 3. Пациент П, 52 лет. Множественные лакунарные очаги в бассейне правой средней мозговой артерии по данным МРТ головного мозга в диффузионном режиме, у пациента с ЛИ на фоне стеноза правой внутренней сонной артерии 80%.
Таблица 1.
Частота встречаемости АГ, СД и дислипидемии в группах больных ЛИ
| Фактор риска | Гипертоническая микроангиопатия n=99 |
Атеросклеротическая микроангиопатия n=80 |
Эмболический генез n=32 |
|||
|---|---|---|---|---|---|---|
| Кол-во | % | Кол-во | % | Кол-во | % | |
| ГБ | 99 | 100,0 | 64 | 80,0% | 26 | 81,3% |
| СД | 13 | 13,1% | 24 | 30,0% | 12 | 37,5% |
| Дислипидемия | 43 | 49,5% | 75 | 93,8% | 28 | 87,5% |
Таблица 2.
Данные МРТ головного мозга в диффузионном режиме в группах больных ЛИ
| МРТ в диффузионном режиме | Гипертоническая микроангиопатия n=99 |
Атеросклеротическая микроангиопатия n=80 |
Эмболический генез n=32 |
|||
|---|---|---|---|---|---|---|
| Кол-во | % | Кол-во | % | Кол-во | % | |
| Единичный маленький (до 15 мм) очаг, либо отсутствие изменений | 84 | 84,9% | 53 | 66,3% | 0 | 0,0% |
| Большой (более 15 мм) или несколько мелких очагов в одном сосудистом бассейне | 13 | 13,1% | 18 | 22,5% | 8 | 25,0% |
| Множественные очаги в нескольких сосудистых бассейнах или несколько крупных очагов (более 15 мм) в одном бассейне | 2 | 2,1% | 9 | 11,2% | 24 | 75,0% |
Кузнецов Алексей Николаевич
Виноградов Олег Иванович
Нижняя Первомайская улица, 70
Москва, Россия, 105203
Телефон: +7 499 464-03-03