Шевченко Ю.Л., Попов Л.В., Тюрин В.П., Гороховатский Ю.И., Василашко В.И., Назаров В.А., Гудымович В.Г., Асташев П.Е., Мамадалиев Д.М.
Национальный медико-хирургический Центр им. Н.И. Пирогова, Москва
Инфекционный эндокардит (ИЭ) — это заболевание сердца, обусловленное воспалительными изменениями его внутренней выстилки, с появлением в зоне деструкции вегетаций микроорганизмов [Шевченко Ю.Л., 2015]. ИЭ является одним из наиболее тяжелых инфекционных заболеваний.
Ежегодно в мире появляются 200000 больных ИЭ. Летальность при консервативном лечении достигает
Абсцессы сердца при ИЭ возникают в
Несмотря столь на далеко шагнувшие достижения кардиохирургического направления, не все особенности этого опасного состояния — гнойника в сердце — доступны для понимания. Даже сейчас столь грозная находка может перечеркнуть все старания оператора.
Для операций на открытом сердце при обширной деструкции структур левого желудочка (ЛЖ) и корня аорты характерна крайняя техническая сложность фиксации, обусловленная воспалением прилежащих тканей, что приводит к грандиозной реконструкции, увеличению длительности искусственного кровообращения (ИК) и операции в целом, повышенному риску массивной инвазии инфекционного агента. Нестандартность в выборе хирургической тактики и разнообразие реконструктивных приемов превращает операцию при абсцедирующей инфекции в искусство — искусство, как полагается, с муками поиска оптимального и наиболее простого решения. Современное лечение инфекционного эндокардита немыслимо без раннего оперативного вмешательства, которое целесообразно выполнять в условиях многопрофильного стационара, используя все преимущества коллективного опыта, накопленного за долгие годы практики.
В отделение кардиологии Пироговского Центра поступил пациент П., 43 лет с жалобами на общую слабость, одышку, учащенное сердцебиение и повышение температуры тела до 39,4ºС. Из анамнеза удалось выяснить, что больной с 2013 года отмечал склонность к повышению артериального давления (АД) до 170 и 90 mm Hg. Впервые обратился за помощью через 2 года, когда при обследовании и был выявлен порок АК.
Пациент был проконсультирован кардиохирургом Пироговского Центра. При подготовке к операции у стоматолога по месту жительства подвергся лечению пульпита одного из моляров, после чего появилась фебрильная лихорадка с ознобом. Больной был госпитализирован в отделение кардиологии городской больницы, где и выявили ИЭ с поражением АК. После безуспешной двухнедельной антибактериальной терапии пациент переведен в отделение кардиологии Пироговского Центра.
При объективном обследовании выявлены: петехиальная сыпь на коже предплечий, голеней и стоп; повышение температуры тела до 39,5ºС; увеличенная частота дыхательных движений (24/мин), ослабление везикулярного дыхания и влажные мелкопузырчатые хрипы в нижних отделах легких; патогномоничное для недостаточности АК повышение систолического и снижение диастолического АД (140/50 mm Hg); приглушенность основных тонов сердца и систоло-диастолический шум во всех точках аускультации, который проводился на сосуды шеи.
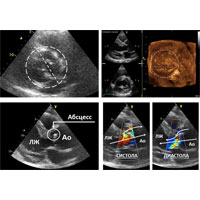
При эхокардиографии (ЭхоКГ) выявлен врожденный порок сердца — двустворчатый АК, а также вегетации как признак инфекционного процесса. У основания АК лоцировалось образование округлой формы — обширный абсцесс корня аорты, полость которого дренировалась как в ЛЖ, так и в аорту, что свидетельствовало о деструкции фиброзного основания клапана (рис. 1).
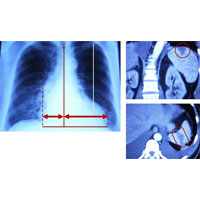
По данным рентгенографии органов грудной клетки отмечалось значительное расширение тени сердца и признаки застоя в малом круге кровообращения (рис. 2). При УЗИ органов брюшной полости и спиральной компьютерной томографии верхнем полюсе селезенки обнаружен очаг деструкции в виде равностороннего треугольника (инфаркт? септический метастаз?).
По результатам лабораторных исследований отмечалось повышение активности печеночных ферментов, концентрации амилазы, мочевины и креатинина; снижение концентрации альбумина; увеличение концентрации NT-proBNP; лейкоцитоз, увеличение СОЭ; нормохромная анемия средней степени тяжести. Таким образом, в динамике наблюдались признаки нарастающей сердечной и полиорганной недостаточности, сепсиса.
На основании жалоб, анамнеза и лабораторно-инструментальных данных установлен клинический диагноз «Основное заболевание: Врожденный порок сердца — двустворчатый аортальный клапан. Вторичный острый инфекционный эндокардит. Комбинированный аортальный порок с преобладанием недостаточности 3 степени. Абсцесс корня аорты. Осложнения: Сепсис. НК IIБ. Легочная гипертензия (СДЛА=40 mm Hg). Абсцесс верхнего полюса селезенки?». По жизненным показаниям пациенту была запланирована двухэтапная симультанная операция: спленэктомия с удалением возможного вторичного очага инфекции в селезенке, а затем санация камер сердца и протезирование АК.
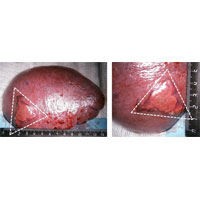
Первым этапом выполнена лапароскопическая спленэктомия. На рис. 3 удаленная селезенка с очагом деструкции, который, как показало дальнейшее гистологической исследование, был представлен инфарктом. Второй этап был кардиохирургическим.
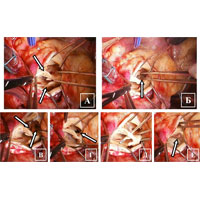
У пациента в условиях ИК рассечена аорта и обнаружен двустворчатый АК (рис. 4 А). В области основания левой коронарной створки выявлена полость абсцесса (рис. 4 Б), а также зона отрыва створки с участком фиброзного кольца (рис. 4 В, Г, Д). На желудочковой поверхности створок выявлены вегетации и участки кальциноза (рис. 4 Е).
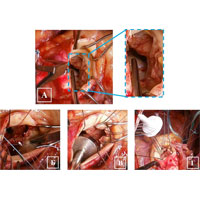
После иссечения АК было обнаружено, что дном абсцесса является расплавленный миокард межжелудочковой перегородки (рис. 5 А). Принято решение выполнить фиксацию протеза в области переднего сектора к стенке аорты ввиду высокого риска прорезывания швов. В аортальную позицию имплантирован механический двустворчатый протез (рис. Б, В, Г).
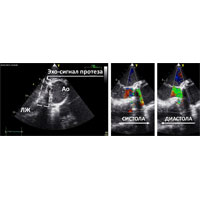
Однако при чреспищеводной эхокардиографии (ЧПЭхоКГ) была обнаружена обширная парапротезная фистула (рис. 6). Предположен отрыв протеза в области переднего сектора и принято решение выполнить ревизию корня аорты.
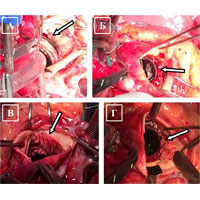
При ревизии подтвердились сомнения: произошел отрыв протеза в области переднего сектора (рис. 7 А). Было найдено нестандартное и рискованное решение: протез фиксирован отдельными узловыми швами на прокладках из ксеноперикарда непосредственно к миокарду (рис. 7 Б). Заплатой из ксеноперикарда устранена полость абсцесса (рис. 7 В), а затем повторно выполнена фиксация переднего сектора протеза (рис. 7 Г).
После остановки ИК контрольная эхокардиография подтвердила успешность хирургического вмешательства. Суммарная длительность этой тяжелой операции составил 10,5 часов, включая 4 часа ИК и 3 часа кардиоплегии.
Чтобы добиться улучшения в послеоперационном периоде, были задействованы силы 9 клинических подразделений Пироговского Центра: отделения кардиология для больных с нарушением ритма, кардиохирургическое отделение, кардиореанимация, второе хирургическое отделение, отделение радионуклидной и функциональной диагностики, отделение ультразвуковых и рентгенохирургических методов диагностики и лечения, отделение рентгено-хирургических методов диагностики и лечения нарушений ритма сердца, терапевтическое отделение, отделение восстановительного лечения. Пациент провел 13 дней в реанимации, из которых 6 дней проводилась искусственная вентиляция легких. Было перелито около 50 литров растворов и крови, применено 7 классов антимикробных препаратов, за время лечения больной принял более двухсот таблеток.
На 31 сутки после операции пациент в удовлетворительном состоянии переведен в отделение кардиологии городской больницы по месту жительства, где после еще 1 месяца реабилитации больной был окончательно выписан для дальнейшего лечения под контролем кардиолога по месту жительства.
Пациент наблюдается специалистами Пироговского Центра. При контрольных осмотрах через 5 и 9 месяцев чувствует себя хорошо, признаков рецидива инфекции не выявлено.
Таким образом, данное клиническое наблюдение является ярким примером особенностей оперативных вмешательств у больных ИЭ, абсцедирующим поражением выходного отдела ЛЖ сердца и корня аорты. К таковым следует отнести непредсказуемость степени и объема деструкции при внутрисердечной инфекции, что влечет за собой нестандартный интраоперационный подход и необходимость принятия экстренных и порой рискованных решений. Течение послеоперационного периода часто крайне тяжелое, требует привлечения максимальных возможностей лечебного учреждения. Только консолидация широкого круга специалистов по ИЭ может обеспечить успешный результат лечения данной категории тяжелобольных.
Несмотря на все трудности лечебного процесса, описанные в данном клиническом наблюдении,