Шевченко Ю.Л., Попов Л.В., Гудымович В.Г., Мамадалиев Д.М.
Национальный медико-хирургический Центр им. Н.И. Пирогова, Москва
Наиболее частой опухолью сердца является миксома или эмбриональная фиброма (более 75% среди всех новообразований этой локализации). Типичное ее расположение — в области овального окна. Нетипичная локализация (как в пределах левого предсердия (ЛП), так и в других камерах сердца) в большинстве требует нестандартного подхода при хирургическом лечении. Сочетание миксомы с аномалиями развития внутрисердечных структур является крайне редким, более того, наличие опухоли в некоторых случаях может служить определенной «маской», ограничивая разрешающие возможности диагностических процедур.
В клинику грудной и сердечно-сосудистой хирургии Пироговского Центра по направлению кардиолога поступил пациент К. 27 лет. При опросе жалоб не предъявлял. Из анамнеза удалось выяснить, что по поводу перенесенного в начале 2015 года простудного заболевания он обратился за помощью к семейному доктору, который назначил лечение и настоял на выполнении эхокардиографического исследования (ЭхоКГ), при котором выявлено новообразование сердца. Это послужило поводом для консультации и дальнейшей госпитализации в кардиохирургический стационар.
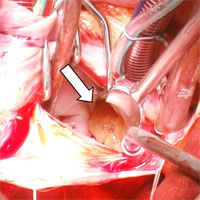
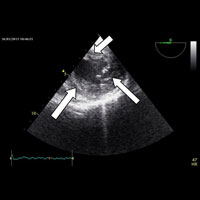
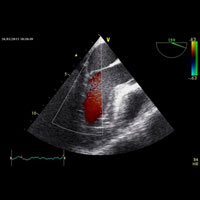
Проведенное дообследование подтвердило наличие в области митрального клапана (МК) подвижного объемного образования диаметром около 20 мм, которое фиксировалось предположительно в проекции фиброзного кольца, или в основании задней створки (рис. 1). Опухоль при сокращении левого желудочка (ЛЖ) пролабировала через атрио-вентрикулярное (А-В) отверстие как в ЛЖ, так и в ЛП. Следует отметить, что при этом нарушения функции клапана не выявлено. Остальные сегменты МК, доступные ультразвуковой оценке, были интактны, патологического градиента давления на клапане не зафиксировано. Другие показатели стандартного протокола ЭхоКГ были в пределах нормальных величин.
1 — ЛП; 2 — ЛЖ; 3 — створки МК; 4 — новообразование; 5 — поток крови в систолу желудочков, которому препятствуют створки МК и новообразование.
На основании данных клинического обследования установлен диагноз «новообразование сердца неясной этиологии (миксома? абсцесс? киста? гемангиома?) с локализацией в области митрального клапана». Учитывая наличие объемного образования, высокий риск его фрагментации или отрыва, невозможность исключения инфекционного или паразитарного генеза, а также опасность скрытой внутрисердечной инфекции или высокую вероятность ее возникновения, принято решение выполнить хирургическое вмешательство — удаление новообразования.
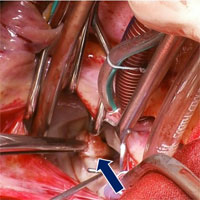
После выполнения правосторонней передне-боковой торакотомии подключен аппарат искусственного кровообращения по схеме «восходящая аорта — полые вены». Аорта пережата, защита миокарда путем нагнетания в корень аорты кардиоплегического раствора «кустодиол» в сочетании с наружным охлаждением сердца тающим льдом. Атриотомия ЛП. В области МК выявлено образование желтого цвета, студенистой консистенции, диаметром около 2 см, полностью пролабировавшее в полость ЛЖ. После фрагментарного удаления основной массы опухоли обнаружена ее «ножка» с широким основанием (диаметр основания до 7 мм), место крепления которой располагалось по свободному краю задней створки (сегмент Р2) с переходом на одну из опорных хорд I порядка, фиксированных в данной зоне (рис. 2).
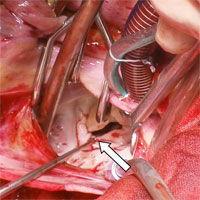
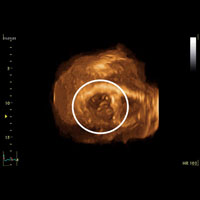
После радикального иссечения образования в пределах здоровых тканей продолжена дальнейшая ревизия с целью оценки анатомических особенностей и функциональной состоятельности МК. Тщательный осмотр задней створки позволил выявить полное ее расщепление до фиброзного кольца с формированием двух отдельных полустворок, содержащих полноценный подклапанный хордальный аппарат (рис. 3). Однако, гидравлическая проба подтвердила состоятельность функции аномального трехстворчатого левого А-В клапана, а также отсутствие повреждения опорных хорд в зоне иссечения опухоли. Учитывая это, внутрисердечный этап операции был завершен.
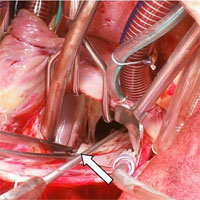
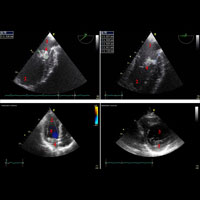
После остановки аппарата ИК выполнена чреспищеводная (ЧП) ЭхоКГ, при которой удалось более подробно (по сравнению с дооперационной) оценить функцию левого А-В клапана и подтвердить полную кооптацию трех его створок (рис. 4).
В дальнейшем неоднократный ЭхоКГ-контроль, в том числе и с использованием
Гистологическое исследование препарата окончательно верифицировало патоморфологию образования — миксомы сердца.
Послеоперационный период протекал без осложнений, на 10 сутки после операции больной выписан для дальнейшего лечения под контролем кардиолога по месту жительства.
Обсуждение
Миксома левых камер сердца является редким заболеванием. Однако среди всех доброкачественных новообразований она выявляется более чем в 50% случаев [2]. В большинстве наблюдений миксомы растут медленно, не нарушая функцию МК. Растущая опухолевая ткань может обтурировать А-В отверстие или фрагментироваться с развитием материальной эмболии [2].
Врожденная недостаточность МК впервые классифицирована А. Карпантье (1983) [3]. Первый из трех типов, согласно данной классификации, характеризуется нормальным движением створок, отсутствием митральной недостаточности или минимальным уровнем регургитации. К нему относится и расщепление задней створки МК (как неполное, так и полное — трехстворчатый А-В клапан). Данная аномалия обнаруживается редко и чаще всего является хирургической находкой.
Золотым стандартом в диагностике расщепления задней створки МК является ЧПЭхоКГ в режиме реального времени и с
В доступной литературе нам не удалось встретить сочетания достаточно редкой аномалии развития МК (трехстворчатый левый А-В клапан) и атипичной локализации миксомы в области свободного края задней створки. Данное клиническое наблюдение позволило сделать некоторые выводы о том, что, несмотря на достаточно малые размеры опухоли, отсутствие клинической симптоматики и молодой возраст пациента, выполненная операция позволила устранить риск жизнеугрожающих осложнений. Трехстворчатое строение левого А-В клапана без функциональной несостоятельности не требует хирургической коррекции, но пациенты с выявленной аномалией должны подвергаться динамическому наблюдению и периодическому ЭхоКГ-контролю.
Литература
- Белозеров Ю.М., Болбиков В.В. Ультразвуковая семиотика и диагностика в кардиологии детского возраста. — М.: МЕДпресс-информ, 2001 — 176 с.
- Шевченко Ю.Л. Хирургическое лечение пациента с гигантской миксомой левого предсердия // Вестник Национального медико-хирургического центра им. Н.И. Пирогова — 2009. — Т. 4. № 1. — С.
136-137. - Carpentier A.F. Cardiac valve surgery — the «French correction» // The Journal of Thoracic and Cardiovascular Surgery — 1983. — Vol. 86, No 3. — P.
323-337. - Jung H.J. Usefulness of intraoperative real-time three-dimensional transesophageal echocardiography for pre-procedural evaluation of mitral valve cleft // Korean Journal of Anesthesiology — 2014. — Vol. 66, No 1. — P.
75-79. - Muller H. Isolated posterior mitral valve cleft: diagnosis by real-time three-dimensional transoesophageal echocardiography // European Journal of Echocardiography — 2010. Vol. 11, No 7. — P. 29.
- Seguela P.E. Isolated cleft of the posterior mitral valve leaflet assessed by real-time 3D echocardiography // Archives of Cardiovascular Disease. — 2011. — Vol. 104. — P.
365-366. - Townsley M.M. Cleft posterior mitral valve leaflet: identification using three-dimensional transesophageal echocardiography // Anesthesia and Analgesia — 2010. — Vol. 11, No 6. — P.
1366-1368. - Wyss C.A. Isolated cleft in the posterior mitral valve leaflet: a congenital form of mitral regurgitation // Clinical Cardiology — 2009. — Vol. 32, No 10. — P.
553–560.