Е.И. Батищева1, А.Н. Кузнецов2
1 Неврологическое отделение ОКБ Святителя Иоасафа, Белгород,
2 Национальный центр патологии мозгового кровообращения НМХЦ им. Н.И.Пирогова, Москва.
Геморрагическая трансформация (ГТ) инфаркта головного мозга на протяжении последних 100 лет изучалась в основном зарубежными исследователями. Fisher and Adams в
Пациенты и методы исследования.
Проведено обследование 239 пациентов с ишемическим инсультом (ИИ) головного мозга в остром периоде, находившихся на лечении в Национальном центре патологии мозгового кровообращения ФГУ НМХЦ им. Н.И.Пирогова (г. Москва) и неврологическом отделении ОКБ Святителя Иоасафа (г. Белгород) с 2004 по 2007 годы. Для анализа полученных данных все обследованные больные (n=239) были разделены на две группы: пациенты с ишемическим инсультом головного мозга — Группа А (n=164); пациенты, перенесшие ишемический инсульт с геморрагической трансформацией ишемического очага — Группа Б (n=75). Нейровизуализацию (КТ и/или МРТ) выполняли на
Результаты.
Произведено сопоставление размеров ишемической области в исследованных группах. (Рис. 1).
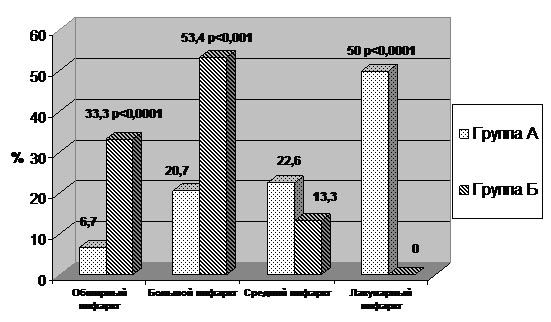
Рисунок 1. Частота встречаемости инфарктов головного мозга различных размеров среди пациентов группы А и группы Б.
Установлено, что обширные и большие инсульты достоверно чаще сопровождались геморрагической трансформацией и были зарегистрированы соответственно в 33,3% и 53,4% случаев среди пациентов с ГТ инфаркта и только у 6,7% и 20,7% пациентов группы А (p<0,0001 и p<0,001). Инсульты среднего размера незначительно преобладали в группе с ишемическим инсультом без геморрагии. Лакунарные инсульты обнаружены исключительно у больных группы А (50% против 0%; p<0,0001). Так как, помимо обширности ишемического поражения, весомое значение для развития интраишемического внутричерепного кровотечения может иметь тяжесть инсульта в дебюте заболевания, нами сопоставлен функциональный и неврологический статус в дебюте заболевания у пациентов с наличием и отсутствием ГТ. Результаты данной оценки приведены в таблице 1.
Таблица 1. Неврологический и функциональный статус пациентов в
Признак |
Группа А Больные, перенесшие ишемический инсульт (n=164) (M±m) |
Группа Б Больные, перенесшие ишемический инсульт с ГТ (n=75) (M±m) |
| Клиническое состояние и функциональный статус пациента в Шкала NIHSS Шкала Глазго Шкала Ранкина |
7.9±4.1 14.4±1.6 3.1±0.8 |
11.5±6,0**** 13.7±2.2**** 3.8±1.1**** |
*****p<0,00001;
Пациенты с развившейся впоследствии геморрагической трансформацией инфаркта головного мозга имели в дебюте заболевания более выраженный неврологический дефицит по Шкале NIHSS (11,5±6,0 против 7,9±4,1; p<0,0001), более глубокий уровень угнетения сознания (13,7±2,2 против 14,4±1,6; p<0,0001) и худший функциональный статус (3,8±1,1 против 3,1±0,8; p<0,0001). Достаточно наглядный результат дает сопоставление частоты встречаемости в
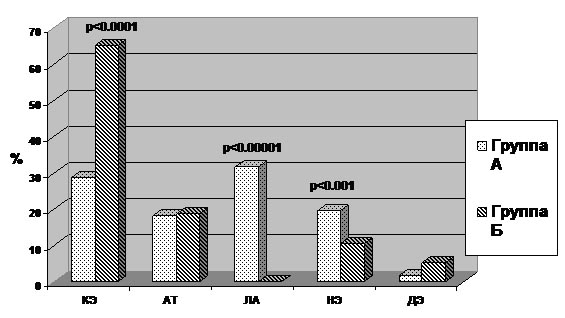
Рисунок 2. Частота различных подтипов ИИ среди пациентов с ИИ без вторичной геморрагии (Группа А) и среди пациентов с геморрагической трансформацией ИИ (Группа Б).
Учитывая большую представленность кардиоэмболии как причинного фактора данного ишемического события была проведена оценка частоты встречаемости тех или иных имеющихся потенциальных источников эмболии среди больных групп А и Б и возможное их участие в развитии последующей геморрагии (Таб. 2).
Таблица 2. Частота встречаемости различных потенциальных источников кардиоцеребральной эмболии среди обследованного контингента.
Признак |
Группа А Больные, перенесшие ишемический инсульт (n=164) |
Группа Б Больные, перенесшие ишемический инсульт с ГТ (n=75) |
| Мерцательная аритмия (пароксизмальная форма) | 20 (12,2%) | 11 (14,7%) |
| Мерцательная аритмия (постоянная форма) | 22 (13,4%) | 23 (30,7%)** |
| Инфаркт миокарда в анамнезе | 19 (11,6%) | 13 (17,3%) |
| Уточненная патология клапанов сердца | 7 (4,3%) | 4 (5,3%) |
| Другие уточненные источники кардиоцеребральной эмболии | 6 (3,7%) | 1 (1,3%) |
| Отсутствие потенциальных кардиогенных источников | 100 (60,9%) | 23 (30,7%) |
*p<0,05; **p<0,01;
Установлено, что группы достоверно не различались по частоте диагностирования пароксизмальной формы мерцательной аритмии, инфаркта миокарда, патологии клапанного аппарата сердца, других источников кардиоцеребральной эмболии. Только постоянная форма мерцательной аритмии обнаружила достоверно большую представленность среди больных с геморрагической трансформацией ишемического инфаркта головного мозга. Она диагностировалась почти у каждого третьего пациента группы с ГТ ишемического очага — 23 (30,7%), и намного реже наблюдалась среди больных группы А — 22 (13,4%; p<0,01). Кроме того, обращает на себя внимание тот факт, что имеющиеся кардиогенные источники с потенциальным образованием красных тромбов в полостях сердца (это постоянная и пароксизмальная формы мерцательной аритмии, инфаркт миокарда) в группе с ГТ совместно составили более 60%, а в группе А наблюдались вдвое реже. Интересной оказалась взаимозависимость мерцательной аритмии и последующего формирования более обширной геморрагии. Так, у больных с постоянной формой мерцательной аритмии частота возникновения паренхимальных гематом почти в два раза превышала частоту возникновения геморрагических инфарктов (p<0,05). Результаты оценки других факторов риска цереброваскулярной патологии продемонстрировали отсутствие достоверных различий в анамнезе среди пациентов с ишемическим инсультом и пациентами с ГТ в частоте диагностирования гипертонической болезни, болезней крови. Сахарный диабет незначительно превалировал среди больных группы А, однако различия между группами были недостоверны (p>0,05) (Таб. 3).
Таблица 3. Частота встречаемости факторов риска цереброваскулярной патологии.
Признак |
Группа А Больные, перенесшие ишемический инсульт (n=164) |
Группа Б Больные, перенесшие ишемический инсульт с ГТ (n=75) |
| Гипертоническая болезнь в анамнезе | 137 (83.5%) | 63 (84%) |
| Болезни крови в анамнезе | 4 (2.4%) | 2 (2.6%) |
| Сахарный диабет в анамнезе | 39 (23.8%) | 12 (16%) |
| Гиперхолестеринемия | 95 (57,9%)** | 28 (37,3%) |
| Ранее перенесенные церебральные сосудистые события (ТИА, инсульты) | 19,5% | 37,3%** |
| АД систолическое максимальное в |
144,6±29,1 | 180,9±37,6**** |
| АД диастолическое максимальное в |
96,6±12,8 | 100,9±20,1* |
*p<0,05; **p<0,01; ***p<0,001; ****p<0,0001;
Установлена обратная корреляционная связь между гиперхолестеринемией в анамнезе и будущим развитием ГТ (57,9% против 37,3%; p<0,01). Кроме того, гиперхолестеринемия диагностирована у 22 (43,1%) больных с геморрагическим инфарктом и у 6 (25%) пациентов с паренхимальной гематомой. Также геморрагические трансформации развивались чаще у пациентов, имеющих церебральные сосудистые события в анамнезе (p<0,01). Зафиксированный нами уровень систолического и диастолического АД в
- Подтип ИИ (бинарная) (х1). За подтип ИИ «1» принимали кардиоэмболический инфаркт; за подтип ИИ «0» — принимали атеротромботический, лакунарный, инсульт другой уточненной причины либо недифференцированный инсульт.
- Наличие ИИ, ТИА в анамнезе (бинарная) (х2). За «1» принимали наличие ИИ, ТИА в анамнезе, за «0» — их отсутствие.
- Размер зоны ИИ (бинарная) (х3). За «1» принимали обширный размер инфарктной зоны у пациента, за «0» — меньшие размеры инфарктов.
- NIHSS (х4) — цифровое выражение тяжести неврологического дефицита, измеренное по шкале NIHSS.
- Наличие сахарного диабета в анамнезе (бинарная) (х5). За «1» принимали наличие сахарного диабета в анамнезе, за «0» — его отсутствие.
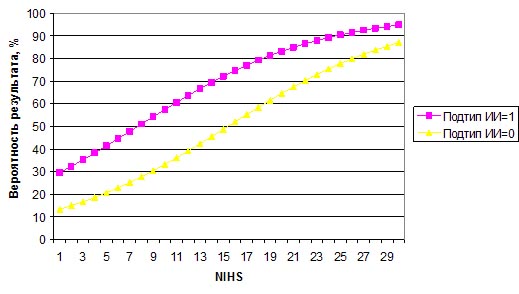
Рисунок 3. Графическое выражение модели logit-регрессии.
По итогам статистического анализа можно сделать вывод, что наличие кардиоэмболического подтипа инсульта увеличивает риск развития ГТ. Причем наибольшая реализация данного фактора происходит в случае инсультов незначительной и умеренной тяжести, где риск возрастает почти вдвое. В случае выраженной тяжести инсульта вероятность геморрагической конверсии при других подтипах инсульта почти сравнивается с кардиоэмболическим.
Обсуждение.
Обширность ишемической зоны — это первый потенциальный предиктор развития ГТ, изученный нами и показавший свою значимость. Убедительное превалирование обширных и больших инсультов среди пациентов с развившейся геморрагической трансформацией закономерно. Большой размер ишемической зоны увеличивает вероятность возникновения патологически повышенной проницаемости стенок сосудов и степень ишемической васкулопатии, в том числе с некрозом сосудистой стенки, что индуцирует развитие интраишемического кровотечения [6, 7, 12, 17, 20, 23]. В корреляции с обширностью области ишемии находится тяжесть неврологического дефицита. Khatry P. et al. называют первоначальную тяжесть инсульта главным предвестником клинически значимой ГТ [17]. По мнению зарубежных исследователей ГТ преимущественно сопровождают инсульты умеренной и выраженной тяжести (со значением шкалы NIHSS >15) [15]. Нами получены аналогичные результаты. Установленный в результате проведенного исследования весомый вклад кардиоэмболии в последующее развитие ГТ еще раз указывает на значимость данного фактора в геморрагической конверсии. Наличие геморрагической трансформации инфаркта мозга много ранее описывалось исследователями как паттерн кардиоэмболического подтипа инсульта [8, 11]. Сопоставимая частота встречаемости атеротромботического подтипа инсульта в группе пациентов с ишемическим инсультом и в группе с геморрагической трансформацией согласуется с мнением Hart и Easton, что при артерио-артериальной эмболии и гемодинамических инфарктах «водораздела», развивающихся при наличии гемодинамически значимых стенозов церебральных артерий, степень ишемии недостаточна для такого нарушения проницаемости сосудистой стенки, которое приводит к геморрагической трансформации [11]. Обращает на себя внимание состав потенциальных источников кардиогенной церебральной эмболии при развитии ГТ. Отмечается заметное преобладание источников с потенциальным образованием красных тромбов в полостях сердца — это постоянная и пароксизмальная формы мерцательной аритмии, инфаркт миокарда, в совокупности составившие более 60%. В основе образования красных тромбов лежит стагнация крови в полостях сердца с последующей активацией каскадов коагуляции [1, 2, 3]. Образование красных тромбов, а также активация собственной тромболитической системы организма, вероятно, являются причиной раннего спонтанного лизиса эмболического субстрата или дистальной миграции фрагментов эмбола с последующей реканализацией артерии и развитием геморрагического инфаркта. Частота спонтанной реканализации при кардиоэмболическом инсульте довольно значительна и составляет 61,8% [21]. В случае развития некроза артериальной стенки, высокая вероятность которого существует при тяжелой ишемии и обширном инфаркте с возможным участием гемодинамических, гемореологических и биохимических процессов, ГТ может протекать по типу паренхимальной гематомы. Роль гипертонической болезни в развитии ГТ изучалась многими исследователями [5, 6, 7, 9, 19]. Однако, как правило, подобная взаимосвязь отрицалась [16]. Мы также не получили подтверждения влияния ГБ в анамнезе на развитие интраишемического кровотечения. Однако максимальный уровень систолического и диастолического АД, зафиксированный нами в
СПИСОК ЛИТЕРАТУРЫ.
- Ворлоу Ч.П., Денис М.С., Гейн Ж.В. и др. Инсульт / Практическое руководство для ведения больных. — СПб: Политехника, 1998. — 629 с.
- Шевченко Ю.Л., Одинак М.М., Михайленко А.А., Кузнецов А.Н. Кардиоэмболический инсульт. — СПб., 1997. — 66 с.
- Шевченко Ю.Л., Одинак M.M, Кузнецов А.Н., Ерофеев А.А. Кардиогенный и ангиогенный церебральный эмболический инсульт (физиологические механизмы и клинические проявления). — М.: ГЭОТАР-Медиа.- 2006.- 270с.
- Adams H.P., Brott T.C., Furlan A.L. et al. Guidelines for trombolytic therapy for acute stroke // Stroke. — 1996. — Vol. 27. — P.
1711–1718. - Adams R.D., Van der Ecken H.M. Vascular diseases of the brain // Ann. Rev. Med. — 1953. — Vol. 4. — P.
213-252. - Alexandrov A.V., Black S.E., Ehrlich L.E. et al. Predictors of hemorrhagic transformation occurring spontaneously and on anticoagulants in patients with acute ischemic stroke // Stroke. — 1997. — Vol. 28. — P.
1198–1202. - Faris A.A. Hardin C.A., Poser C.M. Pathogenesis of hemorrhagic infarction of the brain // Arch. Neurol. — 1963 — Vol. 9. — P.
468-472. - Fisher C.M., Adams R.D. Observations on brain embolism with special refer-ence to the mechanism of hemorrhagic infarction // J. Neuropathol. Exp. Neu-rol. — 1951. — Vol. 10. — P. 92 — 93.
- Globus J.H., Epstein J.A. Massive cerebral hemorrhage: spontaneous and ex-perimentally induced // J. Neuropathol. Exp. Neurol. — 1953. — Vol.12. — P.
107-131. - Hardin C., Hendren T.H., Faris A.A. et al. Pathogenesis of hemorrhagic infarc-tion of the brain // Arch. Neurol. — 1963. — Vol.9. — P.
473-476. - 11. Hart R.G., Easton J.D. Hemorrhagic infarcts // Stroke. — 1986. — Vol. 17. — P.
586-589. - Hornig C.R. Rick evaluation of anticoagulant therapy in cardioembolic stroke / Stroke prevention / Eds W. Dorndorf, P.Marx. — Basel: Karger, 1994. — P. 165-179.
- Horowitz S.H., Zito J.L., Donnarumma R. et al. Computed tomographic-angiographic findings within the first five hours of cerebral infarction // Stroke. — 1991. — Vol.22. — P.
1245-1253. - International Stroke Trial Collaborative Group. The International Stroke Trial (IST): A randomised trial of aspirin, subcutaneous heparin, both, or neither among 19435 patients with acute ischaemic stroke // Lancet. — 1997. — Vol. 349. — P. 1569 —1581.
- Kase C.S., Furlan A.J., Wechsler L.R. and PROACT II investigators. Cerebral hemorrhage after intra-arterial thrombolysis for ischemic stroke: the PROACT II trial // Neurology. — 2001. — Vol. 57. — P.
1603–1610. - Kerenyi L., Kardos L., Sza'sz J. et al. Factors influencing hemorrhagic rans-formation in ischemic stroke: a clinicopathological comparison // Europ. J. of Neurol. — 2006. — Vol. 13. — P.
1251–1255. - Khatri P., Wechsler L.R., Broderick J.P.Intracranial Hemorrhage Associated With Revascularization Therapies // Stroke. — 2007. — Vol. 38. — P.
431-440. - Lodder J., Krijne-Kubat B., Broekman j. Cerebral hemorrhagic infarction at autopsy: cardiac embolic cause and the relationship to the cause of death // Stroke. — 1986. — Vol. 17. — P.626-629.
- Lyden P.D., Zivin J.A. Hemorrhagic transformation after cerebral ischemia: mechanisms and incidence // Cerebrovasc. Brain Met. Rev. — 1993. — Vol. 5. — P.
1-16. - Olsen T.S., Skriver E.B., Herning M. Cause of cerebral infarction in the carotid territory: Its relation to the size and the location of the infarct and to the under-lying vascular lesion // Stroke. — 1985. — Vol. 16. — P.459-466.
- Rha J., Saver J.L. The Impact of Recanalization on Ischemic Stroke Outcome: A Meta-Analysis // Stroke. — 2007. — Vol. 38. — P.
967-973. - Toni D., Fiorelli M., Bastianello S. et al. Hemorrhagic transformation of brain infarct: predictability in the first 5 hours from stroke onset and influence on clinical outcome // Neurology. — 1996. — Vol. 46. — P.
341–345. - Torvik A. The pathogenesis of watershed infarcts in the brain // Stroke. — 1984. — Vol. 15. — P.
221-223.